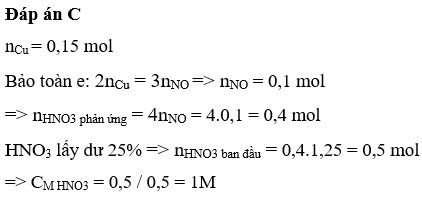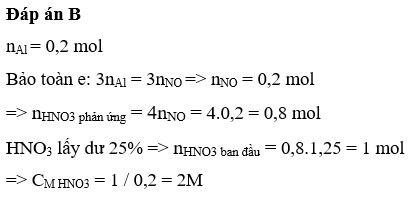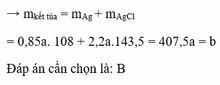Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D.
Ta có: nHCl pư = 2a mol Þ Dung dịch X gồm FeCl2 (a mol) và HCl dư (0,2a mol)
Khi cho AgNO3 dư vào X thì:
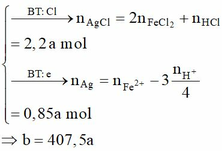

Đáp án A
Từ phản ứng: 3e + 4H+ + NO3- → NO + 2H2O
=> X chứa Fe2+ (0,05 mol), Cu2+, H+, Cl- (0,2 mol).
Khi co X tác dụng với AgNO3 thu được kết tủa là AgCl (0,2 mol) và Ag (0,05 mol) => m ↓ = 34,1 (g)

Đáp án D
Fe + 2HCl →FeCl2 + H2
0,4 ← 0,2 ← 0,2
nHCl dư = nFeCl2 = 0,2
Khi cho AgNO3 vào X
3Fe2+ + 4H+ + NO3- →3Fe3+ + NO + 2H2O
0,15 ← 0,2
Fe2+ + Ag+ →Fe3+ + Ag↓
0,05 → 0,05
Cl- + Ag+ →AgCl↓
0,6 → 0,6
=> m = mAg + mAgCl = 91,5 => Chọn D.

Đáp án C
0,3 mol NaOH phản ứng với dung dịch Y: cuối cùng Natri đi về đâu?
À, trong 0,15 mol NaCl (bảo toàn Cl) và còn lại là 0,15 mol trong NaNO3.
Nhẩm nhanh ở phản ứng Fe + HNO3 → 0,006 mol NO
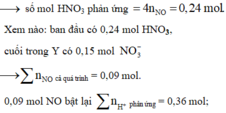
mà tổng HNO3 ban đầu với HCl thêm vào là 0,39 mol.
→ Chứng tỏ rằng trong Y còn dư 0,03 mol H+ nữa.
Rõ hơn quan sát sơ đồ tổng:
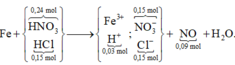
Áp dụng định luật bảo toàn điện tích trong dung dịch Y → số mol Fe là 0,09 mol
→ m = 5,04 gam.