Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

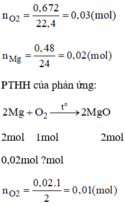
\(n_{Mg}=\dfrac{0.48}{24}=0.02\left(mol\right)\)
\(n_{O_2}=\dfrac{0.672}{22.4}=0.03\left(mol\right)\)
\(2Mg+O_2\underrightarrow{t^0}2MgO\)
\(0.02...0.01\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(0.03...\left(0.03-0.01\right)\)
\(m_{Fe}=0.03\cdot56=1.68\left(g\right)\)
\(m_{hh}=1.68+0.48=2.16\left(g\right)\)

3Fe+2O2= Fe3O4 (1)
2Mg+O2= 2MgO (2)
nMg= 0,48:24= 0,02 mol
theo (2), nO2= 1/2 nMg= 0,01 mol
mà tổng số mol cần dùng là 0,672:22,4= 0,03 mol
=> nO2 ở (1) = 0,02 mol
theo (1), nFe= 3/2 nO2= 0,03 mol
=> mFe= 0,03. 56= 1,68 g

Gọi x,y lần lượt là số mol của S, Fe
nO2 = \(\dfrac{33,6}{22,4}=1,5\) mol
Pt: S + O2 --to--> SO2
......x.....x
.....3Fe + 2O2 --to--> Fe3O4
......y.........\(\dfrac{2y}{3}\)
Ta có hệ pt: \(\left\{{}\begin{matrix}32x+56y=100\\x+\dfrac{2y}{3}=1,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,5\\y=1,5\end{matrix}\right.\)
mS = 0,5 . 32 = 16 (g)
mFe = 100 - 16 = 84 (g)

b) Tính khối lượng H2SO4 dư sau pư, biết H2SO4 đã lấy dư so với lượng pư là 10%
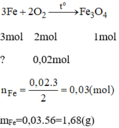
672ml= 0.672l
nO2= 0.672/22.4=0.03 mol
nMg= 0.48/24=0.02 mol
Mg + 1/2O2 -to-> MgO
0.02____0.01
3Fe + 2O2 -to-> Fe3O4
0.03__0.03-0.01
mFe= 0.03*56=1.68g
mhh= 0.48+1.68=2.16g
%Mg= 22.22%
%Fe= 77.78%