Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

P=> 1→1 P2O5 2→2 + H3PO4
H3PO4 3→
=> Na3PO4 4→
+ Ca3(PO4)2
(1) 4P + 5O2 ��→to 2P2O5
(2) P2O5 + 3H2O → 2H3PO4
(3) H3PO4 + NaOH → Na3PO4 + H2O
(4) 2Na3PO4 + 3CaCl2 → 6NaCl + Ca3(PO4)2

1. Định nghĩa về muối
Muối là hợp chất hóa học được tạo thành từ sự kết hợp giữa cation (ion mang điện dương) và anion (ion mang điện âm). Cation có thể là ion kim loại (như Na⁺, Ca²⁺) hoặc ion amoni (NH₄⁺), trong khi anion có thể là ion gốc axit (ví dụ: Cl⁻, SO₄²⁻, NO₃⁻).
- Muối được hình thành khi:
- Ion H⁺ của acid (ví dụ: HCl, H₂SO₄) được thay thế bằng một ion kim loại (ví dụ: Na⁺, Mg²⁺) hoặc ion amoni (NH₄⁺).
- Ví dụ: khi HCl phản ứng với NaOH, ta thu được NaCl (muối clorua natri) và nước.
2. Khả năng tan trong nước của muối
Muối có khả năng hòa tan trong nước khác nhau, phụ thuộc vào các yếu tố như:
- Loại muối: Một số muối tan tốt trong nước, một số muối chỉ tan ít hoặc không tan.
- Nhiệt độ nước: Một số muối có thể tan tốt hơn ở nhiệt độ cao hơn.
- Sự hiện diện của các ion khác trong dung dịch: Các ion có thể ảnh hưởng đến độ tan của muối, ví dụ trong dung dịch bão hòa.
Các nhóm muối có thể phân loại theo khả năng tan:
- Muối tan nhiều: Các muối này có thể hòa tan dễ dàng trong nước, ví dụ NaCl (muối ăn), KNO₃ (muối kali nitrat).
- Muối tan ít: Các muối này hòa tan một lượng nhỏ trong nước, ví dụ AgCl (muối bạc clorua), BaSO₄ (muối bari sulfat).
- Muối không tan: Một số muối gần như không tan trong nước, ví dụ PbSO₄ (muối chì(II) sulfat).
3. Tên muối (chứa cation kim loại)
Khi gọi tên các muối, ta dựa vào hai yếu tố chính: tên của cation (ion mang điện dương) và tên của anion (ion mang điện âm). Quy tắc đặt tên muối chứa cation kim loại được thực hiện như sau:
- Tên kim loại: Nếu kim loại có nhiều hóa trị (như Fe, Cu, Pb, Sn), ta phải chỉ rõ hóa trị của nó bằng cách ghi số hóa trị trong dấu ngoặc đơn sau tên kim loại. Nếu kim loại chỉ có một hóa trị (như Na, K, Ca), ta không cần chỉ hóa trị.
- Tên gốc axit: Đối với gốc axit, ta lấy tên gốc của axit, thay thế "-ic" bằng "-at" đối với axit có gốc axit "-ic" (ví dụ: H₂SO₄ → SO₄²⁻), và thay "-ous" bằng "-it" đối với axit có gốc "-ous" (ví dụ: H₂SO₃ → SO₃²⁻).
Ví dụ:
- FeCl₂: Tên là sắt(II) clorua. Kim loại sắt có hóa trị II, và anion là clorua (Cl⁻).
- FeCl₃: Tên là sắt(III) clorua. Kim loại sắt có hóa trị III, và anion là clorua.
- CuSO₄: Tên là đồng(II) sulfat. Kim loại đồng có hóa trị II, và anion là sulfat (SO₄²⁻).
- NaCl: Tên là natri clorua. Kim loại natri chỉ có hóa trị I, và anion là clorua.
Tóm tắt lại các điểm quan trọng:
- Muối là hợp chất tạo thành từ sự thay thế ion H⁺ của axit bởi ion kim loại hoặc ion amoni (NH₄⁺).
- Khả năng tan trong nước của muối có sự khác biệt rõ rệt, có muối tan tốt, muối tan ít và muối không tan.
- Cách gọi tên muối: Tên muối bao gồm tên cation (kèm hóa trị nếu cần) và tên gốc của axit.

đặt \(m_{quặng}\)= a(g).
Ta có: \(m_{CaCO_3}\)= 0,8.a (g)
=> n\(_{CaCO_3}\)=\(\dfrac{0,8.a}{100}\)=0,008.a (mol)
Vì H%=90% => n\(_{CaO}\)\(_{Thu}\)\(_{được}\)=0,008.a.0,9=0,0072.a(mol)
Ta có : n\(_{CaO}\)\(_{Thu}\)\(_{được}\)= \(\dfrac{7000000}{56}\)=125000(mol).
=> 0,0072.a=125000 => a=17361111,11(g)
=17,36111 ( tấn)
Vậy cần 17,36111 tấn quặng
đặt ���ặ��mquặng= a(g).
Ta có: �����3mCaCO3= 0,8.a (g)
=> n����3CaCO3=0,8.�1001000,8.a=0,008.a (mol)
Vì H%=90% => n���CaO�ℎ�Thuđượ�được=0,008.a.0,9=0,0072.a(mol)
Ta có : n���CaO�ℎ�Thuđượ�được= 700000056567000000=125000(mol).
=> 0,0072.a=125000 => a=17361111,11(g)
=17,36111 ( tấn)
Vậy cần 17,36111 tấn quặng

nO2=a;nN2=4a��2=�;��2=4�
PTHH: 2SO2+O2V2O5⟷2SO32��2+�2⟷�2�52��3
Bđ: a� a�
Pư: 2x2� x� 2x2�
Sau: a−2x�−2� a−x�−� 2x2�
Bảo toàn khối lượng: mA=mB⇒nA.

Tóm tắt về axit (acid):
- Khái niệm axit:
Axit là những hợp chất phân tử chứa nguyên tử hydrogen liên kết với gốc axit. Khi tan trong nước, axit giải phóng ion \(H^{+}\). - Cấu tạo:
Công thức phân tử axit gồm một hoặc nhiều nguyên tử hydrogen và một gốc axit (gốc phần còn lại của phân tử). - Tính chất:
- Dung dịch axit làm giấy quỳ tím chuyển sang màu đỏ.
- Một số kim loại phản ứng với dung dịch axit, tạo ra muối và khí hydrogen \(H_{2}\).
- Ứng dụng:
Các axit như sulfuric acid (H₂SO₄), hydrochloric acid (HCl), acetic acid (CH₃COOH) có nhiều ứng dụng quan trọng trong sản xuất và đời sống hàng ngày.

a) Dần xuất hiện kết tủa trắng.
\(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgNO_3\)
\(b)n_{CaCl_2}=\dfrac{2,22}{111}=0,02mol\\ n_{AgNO_3}=\dfrac{1,7}{170}=0,01mol\\ \Rightarrow\dfrac{0,02}{1}< \dfrac{0,01}{2}\Rightarrow CaCl_2.dư\\ CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl\)
0,005 0,01 0,005 0,01
\(m_{AgCl}=0,01.143,5=1,435g\\ c)C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,005}{0,07}=\dfrac{1}{14}M\\ C_{M_{CaCl_2.dư}}=\dfrac{0,02-0,005}{0,07}=\dfrac{3}{14}M\)

Mình hệ thống lại tính chất hóa học của các loại oxit để bạn dễ học nhé 👇
1. Oxit axit (thường là oxit của phi kim hoặc kim loại có số oxi hoá cao, ví dụ: SO₂, CO₂, P₂O₅, N₂O₅, …)
- Tác dụng với nước → tạo dung dịch axit.
\(S O_{3} + H_{2} O \rightarrow H_{2} S O_{4}\) - Tác dụng với bazơ → tạo muối và nước.
\(C O_{2} + C a \left(\right. O H \left.\right)_{2} \rightarrow C a C O_{3} \downarrow + H_{2} O\)
2. Oxit bazơ (thường là oxit của kim loại, ví dụ: Na₂O, CaO, CuO, Fe₂O₃, …)
- Tác dụng với nước → tạo dung dịch bazơ (nếu oxit tan).
\(C a O + H_{2} O \rightarrow C a \left(\right. O H \left.\right)_{2}\) - Tác dụng với axit → tạo muối và nước.
\(C u O + 2 H C l \rightarrow C u C l_{2} + H_{2} O\)
3. Oxit lưỡng tính (ZnO, Al₂O₃, Cr₂O₃, …)
- Tác dụng với axit → tạo muối và nước.
\(Z n O + 2 H C l \rightarrow Z n C l_{2} + H_{2} O\) - Tác dụng với bazơ mạnh (khi nung nóng hoặc dung dịch kiềm đặc) → tạo muối và nước.
\(Z n O + 2 N a O H \rightarrow N a_{2} Z n O_{2} + H_{2} O\)
4. Oxit trung tính (CO, NO, N₂O, …)
- Không tác dụng với axit, bazơ, muối, cũng không tác dụng với nước.
✅ Tóm gọn:
- Oxit axit + bazơ → muối + nước.
- Oxit bazơ + axit → muối + nước.
- Oxit lưỡng tính + axit/bazơ → muối + nước.
- Oxit trung tính: hầu như không phản ứng.

Người bị đau dạ dày không nên sử dụng các thực phẩm:
Dấm, mẻ vì chúng có nhiều a - xít làm cho dạ dày bị bào mỏng, kích thích dạ dày và làm cho bệnh viêm loét dạ dày càng tiến triển nhanh và khó lành.

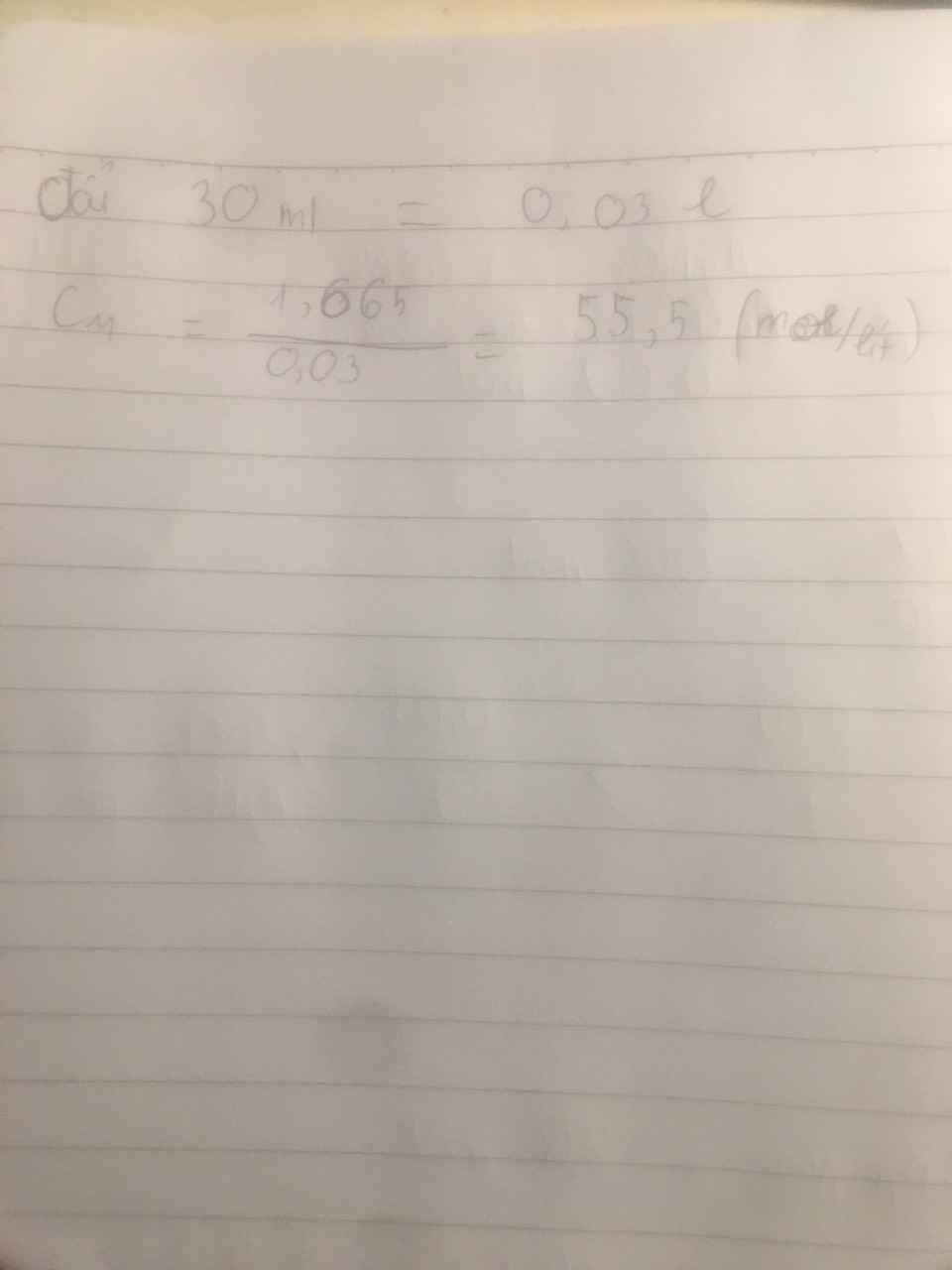
Ta có: \(n_{Al}=\dfrac{4,86}{27}=0,18\left(mol\right)\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a, \(n_{HCl}=3n_{Al}=0,54\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,54}{0,15}=3,6\left(M\right)\)
b, \(n_{AlCl_3}=n_{Al}=0,18\left(mol\right)\Rightarrow m_{AlCl_3}=0,18.133,5=24,03\left(g\right)\)
c, \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,27\left(mol\right)\Rightarrow V_{H_2}=0,27.24,79=6,6933\left(l\right)\)