
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
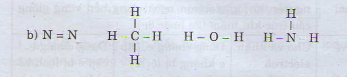
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

1)
2KCl + 2H2O --( Điện phân dd có màng ngăn )--> 2KOH + Cl2 + H2
2KOH+ MgCl2 -> 2KCl + Mg(OH)2
2KCl + 2H2O --( Điện phân dd có màng ngăn )--> 2KOH + Cl2 + H2
2Cl2 + 2H2O -> 4HCl + O2
2HCl + Fe(OH)2 -> FeCl2 + 2H2O
2FeCl2 + Cl2 -> 2FeCl3
2FeCl3 + Fe --to, xt-> 3FeCl2
2)
3Cl2 + 6KOHdamdac --to-> 5KCl + KClO3 + 3H2O
2KClO3 \(\xrightarrow[to]{MnO2}\) 2KCl + 3O2
3) Cl2 + 2KOH -> H2O + KCl + KClO
giải hộ em vs :để thu được 5,6 tấn vôi sống H% 95% tính CaCo3 ? cần dùng

Ankan + O2 \(\rightarrow\) CO2 + H2O
Ta có nH2O=\(\frac{27}{18}\)=1,5 mol\(\rightarrow\) nH trong ankan=2nH2O=3 mol
\(\rightarrow\) mC trong ankan=17,4-3=14,4 gam \(\rightarrow\) nC=\(\frac{14,4}{12}\)=1,2 mol
\(\rightarrow\)Hỗn hợp ankan chứa 1,2 mol C và 3 mol H \(\rightarrow\) nCO2=nC=1,2 mol
\(\rightarrow\)n ankan=nH2O -nCO2=1,5-1,2=0,3 mol
\(\rightarrow\) C trung bình ankan=\(\frac{1,2}{0,3}\)=4
Vì 2 ankan cùng thể tích nên số C là trung bình cộng, mặt khác chung đều là thể khí nên số C từ 4 trở xuống.
\(\rightarrow\) Nếu một ankan có số C nhỏ hơn 4 \(\rightarrow\) Ankan còn lại phải hơn 4
\(\rightarrow\) 2 ankan phải cùng 4 C \(\rightarrow\)Đều là C4H10 nhưng khác CTCT
\(\rightarrow\)CH3-CH2-CH2-CH3 và CH3-CH(CH3)-CH3
b) CH3-CH2-CH2-CH3 + Cl2 \(\underrightarrow{^{as}}\) CH3-CHCl-CH2-CH3 + HCl
CH3-CH(CH3)-CH3 + Cl2 \(\underrightarrow{^{as}}\) CH3-CCl(CH3)-CH3

Câu 1. Dãy các đơn chất nào sắp xếp theo chiều tính phi kim tăng dần?
A. F 2 , Cl 2 , I 2 , Br 2 . B. I 2 , Br 2 , Cl 2 , F 2 .
C. F 2 , Cl 2 , Br 2 , I 2 . D. I 2 , Cl 2 , F 2 , Br 2 .
Câu 2. Trong chu kỳ 3 của bảng tuần hoàn các nguyên tố hóa học, từ Na đến Cl
A. tính kim loại của các nguyên tố tăng dần.
B. tính phi kim của các nguyên tố tăng dần.
C. tính kim loại của các nguyên tố giảm dần đồng thời tính phi kim của các nguyên tố
tăng dần.
D. tính kim loại của các nguyên tố tăng dần đồng thời tính phi kim của các nguyên tố
giảm dần.

\(MnO_2+4HCl_đ\underrightarrow{t^o}MnCl_2+Cl_2+2H_2O\)
\(Cl_2+H_2\underrightarrow{t^o}2HCl\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
\(2NaCl+2H_2O\xrightarrow[cmn]{đpdd}2NaOH+Cl_2+H_2\)
MnO2 + 4HCl →→ MnCl2 + Cl2 + 2H2O
Cl2 + H2 →→ 2HCl
HCl + NaOH →→ NaCl + H2O
2NaCl + 2H2O →���đ���đpddcmn 2NaOH + H2 + Cl2

- HNO2 :
+ H : I
+ N : III
+ O : II
- HClO :
+ H : I
+ Cl : I
+ O : II
- HClO3 :
+ H : I
+ Cl: V
+ O : II
- HClO4 :
+ H : I
+ Cl : VII
+ O : II
Cù Văn Thái thầy xem giúp em với ạ, có nhiều chổ em làm đại chứ không biết đúng hay sai nữa.

1/ C + 2H2 -Ni,500oC-> CH4
2/ CH3COONa + NaOH -CaO, to-> CH4↑ + Na2CO3
3/ Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3↓
4/ CH4 + 2O2 -to-> CO2↑ + 2H2O
5/ CH4+ 2Cl2 -as-> CH2Cl2 + 2HCl↑
6/ CH2Cl2 + Cl2 -as-> CHCl3 + HCl ↑
7/ CHCl3 + Cl2 -as-> CH2Cl2 + HCl↑
8/ C2H4 + H2 →Ni C2H6↑
9/ n(CH2=CH2) →to, P (-CH2-CH2-)n(PE)
10/ C2H5OH →H2SO4đ C2H4↑ + H2O
11/ C2H2 + H2 →to, Pb C2H4↑
12/ CaC2 + 2H2O → C2H2↑ + Ca(OH)2

Dãy gồm các phi kim thể khí ở điều kiện thường là: Cl2, H2, N2, O2
Loại A vì S ở thể rắn
Loại B và D vì Br 2 ở thể lỏng
Đáp án: C