Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
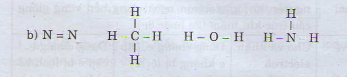
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.

4 ý cuối :
1)
Cu + 2H2SO4→ CuSO4+ SO2+2H2O
Cu0 →Cu+2 +2e║ x1
S+6+2e →S+4 ║ x1
2)
2Al+ 4H2SO4→ Al2(SO4)3+ S+ 4H2O
2Al0→2Al+3 +6e║x1
S+6 +6e→S0 ║x1
3)
4Zn +5H2SO4→ 4ZnSO4+ H2S+ 4H2O
Zn0\(\rightarrow\) Zn+2 +2e ║x4
S+6 +8e →S−2 ║x1
4)
8Fe+ 15H2SO4→ 4Fe2(SO4)3+3H2S+ 12H2O
2Fe0→ 2Fe+3+6e║x4
S+6 +8e →S−2 ║x3
6 ý đầu
1.\(\overset{-3}{4NH_2}+\overset{0}{5O_2}\rightarrow\overset{+2+6}{4NO}+\overset{-2}{6H_2O}\)
4 X \(||\) N-3 + 5e → N+2
5 X \(||\) 2O0 + 4e → 2O-2
2.\(\overset{-3}{4NH3}+\overset{0}{3O_2}\rightarrow\overset{0}{2N_2}+\overset{-2}{6H_2O}\)
2 X \(||\) 2N-3 + 6e → 2N0
3 X \(||\) 2O0 + 4e → 2O-2
3.\(\overset{0}{3Mg}+\overset{+5}{8NO_3}\rightarrow\overset{+2}{3Mg\left(NO_3\right)_2}+\overset{+2}{2NO}+\overset{ }{4H_2O}\)
3 X \(||\) Mg0 → Mg+2 + 2e
2 X \(||\) N+5 + 3e → N+2
4.\(\overset{0}{Al}+\overset{+5}{6NO_3}\rightarrow\overset{+3}{Al\left(NO_3\right)_3}+\overset{+4}{3NO_2}+\overset{ }{3H_2O}\)
1 X \(||\) Al0 → Al+3 + 3e
3 X \(||\) N+5 + 1e → N+4
5.\(\overset{0}{Zn}+\overset{+5}{4HNO_3}\rightarrow\overset{+3}{Fe\left(NO_3\right)_3}+\overset{+2}{NO}+\overset{ }{2H_2O}\)
1 X \(||\) Zn0 → Mg+2 + 2e
2 X \(||\) N+5 + 3e → N+4
6.\(\overset{0}{Fe}+\overset{+5}{4HNO_3}\rightarrow\overset{+3}{Fe\left(NO_3\right)_3}+\overset{+2}{NO}+\overset{ }{2H_2O}\)
1 X \(||\) Fe0 → Fe+3 + 3e
1 X \(||\) N+5 + 3e → N+2

2.
Na2O: Na điện hoá trị 1+, O điện hoá trị 2-
HF: H điện hoá trị 1+, F điện hoá trị 1-
KCl: K điện hoá trị 1+, Cl điện hoá trị 1-
H2S: H cộng hoá trị I, S cộng hoá trị II
1.a,
Δχ= 2,51 => Liên kết ion
Nguyên tử Na nhường 1e tạo cation Na+. Nguyên tử O nhận 2e tạo anion O2−. Một O2− hút 2 Na+ về phía mình nhờ lực hút tĩnh điện, tạo liên kết ion.
b,
Δχ= 1,78 => Liên kết ion
Nguyên tử H nhường 1e tạo cation H+ Nguyên tử F nhận 1e tạo anion F− Một F− hút một H+ về phía mình nhờ lực hút tĩnh điện, tạo liên kết ion.
c,
Δχ= 2,34 => Liên kết ion
Nguyên tử K nhường 1e tạo cation K+. Nguyên tử Cl nhận 1e tạo anion Cl−. Một K+ hút 1 Cl− về phía mình nhờ lực hút tĩnh điện, tạo liên kết ion.
d,
Δχ= 0,38 => Liên kết cộng hoá trị không cực
Nguyên tử S có 2e độc thân. Mỗi e độc thân ghép đôi với 1 nguyên tử H có 1e độc thân. Mỗi cặp e ghép đôi tạo 1 liên kết trong phân tử H2S.
Đáp án B