Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Mg}=\dfrac{13.44}{24}=0.56\left(mol\right)\)
TN1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.56................................0.56\)
TN2 :
\(MCO_3+H_2SO_4\rightarrow MSO_4+CO_2+H_2O\)
\(x............................x\)
Vì cân thăng bằng nên :
\(m_{Mg}-m_{H_2}=m_{MCO_3}-m_{CO_2}\)
\(\Rightarrow13.44-0.56\cdot2=22-44x\)
\(\Rightarrow x=0.22\)
\(M_{MCO_3}=\dfrac{22}{0.22}=100\left(g\text{/}mol\right)\)
\(\Rightarrow M=100-60=40\left(g\text{/}mol\right)\)
\(M:Ca\)

CaCO3+ H2SO4-> CaSO4+CO2+H2O
0.05 0.05
-> khối lượng bình A sau phản ứng tăng 5-0.05x44=2.8 g
cân trở lại vị trí cân bằng -> khối lượng bình B cũng tăng 2.8g
->4,787 - 44nC(X) = 2,8
-> nC(X) = nX = 1,987/44 (cái này không làm tròn thì PTK của X ra đúng hơn!)
->Mx= 106
-> A : Na2CO3

Các phản ứng hoá học xảy ra trên hai đĩa cân :
CaCO 3 + 2 HNO 3 → Ca NO 3 2 + H 2 O + CO 2
MgCO 3 + 2 HNO 3 → Mg NO 3 2 + H 2 O + CO 2
Vị trí của hai đĩa cân trong thí nghiệm lần thứ nhất :
Số mol các chất tham gia ( 1 ) : n CaCO 3 = 20/100 = 0,2 mol bằng số mol HNO 3
Số mol các chất tham gia (2) : n MgCO 3 = 20/84 ≈ 0,24 mol nhiều hơn số mol HNO 3
Như vậy, toàn lượng HNO 3 đã tham gia các phản ứng (1) và (2). Mỗi phản ứng đều thoát ra một lượng khí CO 2 là 0,1 mol có khối lượng là 44 x 0,1 = 4,4 (gam). Sau khi các phản ứng kết thúc, 2 đĩa cân vẫn ở vị trí thăng bằng.

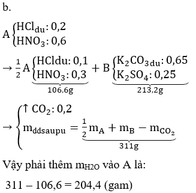
a.
|
|
AgNO3 |
K2CO3 |
| Ban đầu |
0,6 mol; 102 gam |
0,9 mol; 124,2 gam |
| Thêm vào |
→ HCl : 0 , 1 mol ↓ AgCl : 0 , 6 mol |
← H 2 SO 4 : 0 , 25 ↑ CO 2 : 0 , 25 |
| Sau phản ứng |
115,9gam |
213,2 gam |
| Thêm nước |
213,2 – 115,9 = 97,3 gam |
|
*Cốc B :
mcốc B ( sau ) = \(m_{Ag}+m_{ddHCl}=85+100=185\left(g\right)\)
( do Ag không tác dụng với HCl )
* Cốc A :
\(m_{H_2SO_4}=\frac{C\%.m_{dd}}{100\%\%=1}=19,6\left(g\right)\)
=> \(n_{H_2SO_4}=\frac{m}{M}=0,2\left(mol\right)\)
- Gỉa sử H2SO4 phản ứng hết .
=> \(m_{hh}=m_{NaHCO_3}+m_{KHCO_3}=0,2.184=36,8\left(g\right)\)
Ta thấy : \(m_{hh\left(sau\right)}< m_{hh}\left(36,8< 120\right)\)
=> Sau phản ứng H2SO4 phản ứng hết , hh còn dư .
\(2NaHCO_3+H_2SO_4\rightarrow Na_2SO_4+2H_2O+2CO_2\)\(2KHCO_3+H_2SO_4\rightarrow K_2SO_4+2H_2O+2CO_2\)
=> \(n_{CO_2}=2n_{H_2SO_4}=0,4\left(mol\right)\)
=> \(m_{CO_2}=n.M=17,6\left(g\right)\)
Áp dụng định luật bảo toàn khối lượng :
=> mcốc A ( sau ) = \(m_{hh}+m_{H_2SO_4}-m_{CO_2}\)
\(=120+100-17,6=202,4\left(g\right)\)
Vậy sau thí nghiệm cân không ở vị trí cân bằng .
Ta có : \(m_A-m_B=17,5\left(g\right)\)
Vậy cần thêm 17,5 g dd HCl 36,5 % để cần về vị trí ban đầu .
mình rất rất cảm mơn bạn !! ONE LIKE FOR YOU!!