Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(FeO + CO \xrightarrow{t^o} Fe + CO_2\\ FeO + H_2 \xrightarrow{t^o} Fe + H_2O\\ CuO + CO \xrightarrow{t^o} Cu + CO_2\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\\)
b) Khối lượng hỗn hợp giảm chính là khối lượng O(oxit) phản ứng .
\(H_2 + O_{oxit} \to H_2O\\ CO + O_{oxit} \to CO_2\\ n_{O(oxit)} = n_{H_2} + n_{CO} = \dfrac{5,6}{22,4} = 0,25(mol)\\ \Rightarrow a = m_O = 0,25.16 = 4(gam)\)

Phương trình hóa học:
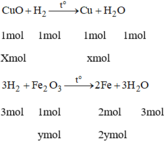
Gọi x là số mol của CuO
y là số mol của F e 2 O 3 .
Ta có: 80x + 160y = 16 (1)
Khối lượng hỗn hợp giảm do oxit tạo thành kim loại:
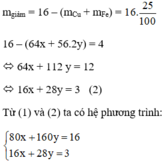
Giải hệ phương trình ta được:
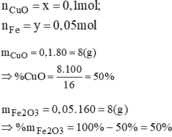

\(a.MgCO_3-t^{^0}->MgO+CO_2\\ CaCO_3-t^{^0}->CaO+CO_2\\ b.n_{MgCO_3}=a,n_{CaCO_3}=b\\ 84a+100b=26,8\\ 40a+56b=13,6\\ a=0,2;b=0,1\\ \%m_{MgCO_3}=\dfrac{84a}{26,8}.100\%=62,69\%\\ \%m_{CaCO_3}=37,31\%\\ c.V_{CO_2}=22,4\left(a+b\right)=6,72L\)

Cho hỏi chỗ sơ đồ đường chéo 4 và 12 là như nào đấy ạ .___.
Còn cả chỗ suy ra 42x-28y=0

$m_{O\ trong\ oxit} = m_{giảm} = 20.24\%= 4,8(gam)$
$\Rightarrow n_O = \dfrac{4,8}{16} = 0,3(mol)$
Gọi $n_{Fe_2O_3} = a(mol) ; n_{CuO} = b(mol) \Rightarrow 160a + 80b = 20(1)$
Ta có : $n_O = 3a + b = 0,3(2)$
Từ (1)(2) suy ra : a = 0,05 ; b = 0,15
$\%m_{CuO} = \dfrac{0,15.80}{20}.100\% = 60\%$

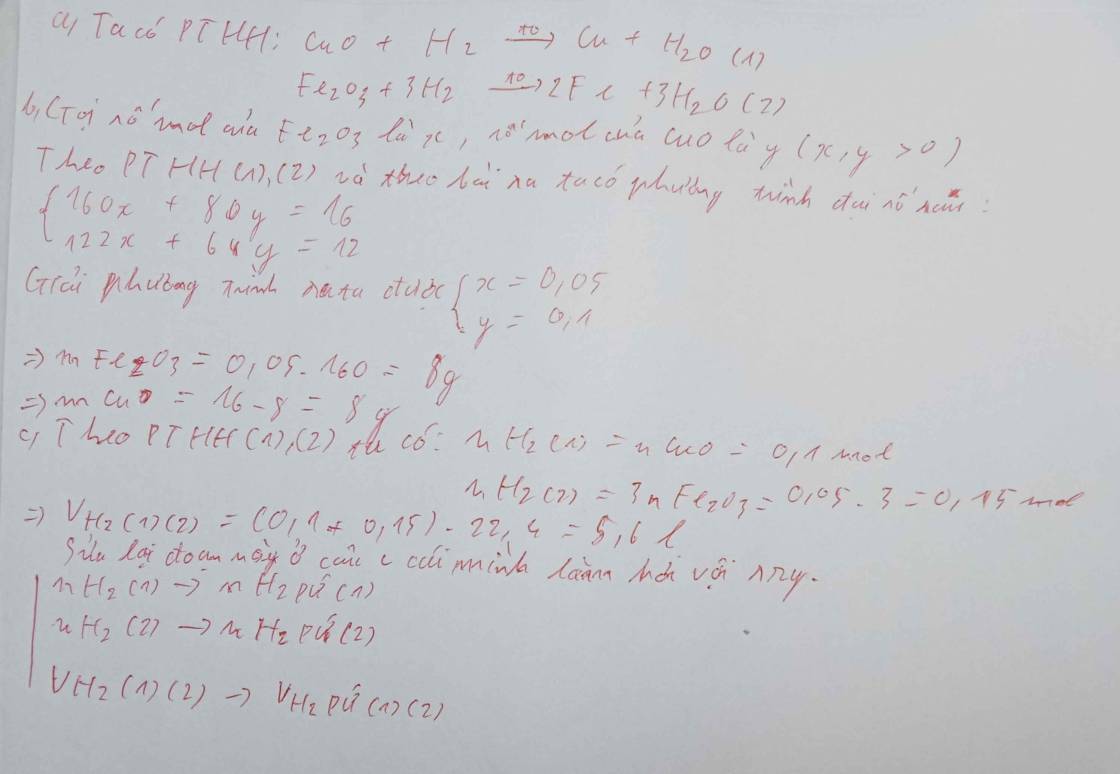

+PTHH:
CuO + CO => Cu + CO2
FeO + CO => Fe + CO2
CuO + H2 => Cu + H2O
FeO + H2 => Fe + H2O
Ta có: n hỗn hợp khí = V/22.4 = 5.6/22.4 = 0.25 (mol)
Suy ra: nO = nCO2 + nH2O = 0.25 (mol)
a = mO = n.M = 0.25 x 16 = 4 (g)
hỗn hợp khí = 0.45 x 16 = 7.2
Theo phương pháp đường chéo
Ta suy ra: nCO/nH2 = 11/54
Suy ra: VCO/VH2 = 11/54
===> %VCO = 16.92 (%), %VH2 = 83.08 (%)
a) PTHH: CO + CuO \(\underrightarrow{t^o}\) Cu + CO2\(\uparrow\)
H2 + CuO \(\underrightarrow{t^o}\) Cu + H2O