Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
● Cách 1: Tính toán theo phương trình phản ứng
Theo giả thiết, suy ra : Y gồm C 2 H 2 , C 2 H 4 , C 2 H 6 và có thể có H 2 . Z có C 2 H 6 và có thể có H 2 .
Dựa vào số mol của các chất Br2, C2Ag2, CO 2 , H 2 O và bản chất phản ứng, ta có :
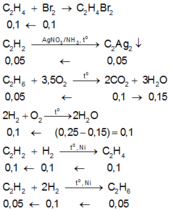
Suy ra :
n H 2 trong X = 0 , 3 ; n C 2 H 2 trong X = 0 , 2 V X đktc = V C 2 H 2 + V H 2 = 11 , 2 lít
● Cách 2: Sử dụng phương pháp bảo toàn nguyên tố
Theo giả thiết, suy ra :
n C 2 H 2 dư = n C 2 Ag 2 = 0 , 05 ; n C 2 H 4 = n Br 2 = 0 , 1 ; n H 2 O = 0 , 25
Nhận xét : Các chất trong X đều chứa 2 nguyên tử H. Mặt khác, số mol của C 2 H 2 dư, C 2 H 4 và H 2 O đều đã biết. Vậy áp dụng bảo toàn nguyên tố H là tính được số mol của hỗn hợp X. Vì thế không mất nhiều thời gian viết phương trình phản ứng và tính toán như cách 1.
Áp dụng bảo toàn nguyên tố đối với H, ta có :
2 n H 2 + n C 2 H 2 ⏟ n X = 2 n C 2 H 2 dư ⏟ 0 , 05 + 4 n C 2 H 4 ⏟ 0 , 1 + 2 n H 2 O ⏟ 0 , 25 ⇒ n X = 0 , 5 mol ⇒ V X đktc = 11 , 2 lít

Đáp án C
Xử lí dữ kiện Z: Bảo toàn khối lượng:
![]() = 6,12 gam
= 6,12 gam
→![]() gam →
gam →
![]() mol
mol
→ ![]() gam →
gam →
![]() mol.
mol.
![]()
![]() gam
gam
![]() mol
mol
![]()
![]()
Ta có phản ứng Dumas: -COONa + NaOH → -H + Na2CO3 (vôi tôi xút).
![]()
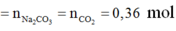
![]()
![]()
K gồm 2 khí trong đó có CH4.
Mà sau khi dẫn qua dung dịch Br2 dư chỉ còn 1 khí thoát ra
⇒ khí còn lại bị hấp thụ.
![]()
trong A chứa 2 gốc CH3COO-
⇒ gốc còn lại cũng là gốc axit đơn chức
⇒ nkhí còn lại = nA = 0,12 mol.
⇒ Mkhí còn lại =
![]()
khí còn lại là C2H4.
⇒ là (CH3COO)2(CH2=CH-COO)C3H5
⇒ a = 0,12 . 230 = 2,76
![]() mol
mol
⇒ x = 0,38 ÷ 0,19 = 2.
Muối gồm 0,12 mol
![]() ;
;
0,24 mol CH3COONa; 0,02 mol NaCl
=> b = 0,12.94 + 0,24.82 + 0,02.58,5 = 32,13
=> a + b + x = 61,73 gam

Đáp án A
Xử Lý hỗn hợp khí X: 3 khí đó chỉ có thể là NO, N2 và N2O.
NO + ½O2 → NO2 và bị giữ lại bởi NaOH.
⇒ Hỗn hợp khí Y chứa N2 và N2O với MTrung bình = 36 = MTrung bình cộng của 2 khí.
⇒ nN2 = nN2O || Đặt nNO = a và nN2 = nN2O = b ta có hệ:
a + 2b = 0,04 || 30a + 28b + 44b = 1,32 ||⇒ a = 0,02 và b = 0,01.
⇒ ∑ne cho nhận = 3nNO + 10nN2 + 8nN2O = 0,24 mol.
● Đặt số mol 2 kim loại lần lượt là x và y ta có hệ:
(24+17×2)x + (27+17×3)y = 6,42 || 2x + 3y = 0,24.
⇒ nMg = 0,03 và nAl = 0,06 mol ⇒ mHỗn hợp kim loại = 2,34 gam
+ Bảo toàn nguyên tố Nitơ ⇒ nHNO3 đã pứ = 0,24 + 0,02 + 0,01×2×2 = 0,3 mol.
⇒ ∑nHNO3 ban đầu = 0,3 + 0,3×0,15 = 0,345 mol.
⇒ mDung dịch HNO3 = 0 , 345 × 63 × 100 24 = 90,5625 gam

Đáp án C
Gọi số mol H 2 O sinh ra trong phản ứng thủy phân và phản ứng đốt cháy lần lượt là n H 2 O 1 và n H 2 O 2 . Áp dụng bảo toàn nguyên tố Na cho toàn bộ quá trình phản ứng và bảo toàn khối lượng trong phản ứng của X với NaOH, ta có :
n NaOH = 2 n Na 2 CO 3 = 2 . 6 , 36 : 106 = 0 , 12 m X ⏟ 6 , 08 + m NaOH ⏟ 0 , 12 . 40 = m muối ⏟ 9 , 44 + 18 n H 2 O ( 1 ) ⏟ ?
n H 2 O 1 = 0,08
Theo bảo toàn nguyên tố C, H và giả thiết, ta có
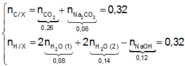
![]()
= 0,12 mol

TN1 → nCHO = 0,5 nAg = 0,2 mol
TN2→ nHCO3 = nCOOH = 0,2 mol
TN3: nCOO = nKOH = 0,4 mol > nCOOH
→ chứng tỏ Y chứa nhóm COO: 0,2 mol, CHO: 0,2 mol.
Bảo toàn nguyên tố K → nK2CO3 = 0,5nKOH = 0,2 mol
Có ∑ nC ( muối) = nCO2 + nK2CO3 = 0,6 mol = nCOOH + nCHO + nCOO
Y tạp chức → chứng tỏ X là (COOH)2: 0,1 mol và Y là HOC-COOR': 0,2 mol
Ancol Z + Na → muối + H2
→ mancol = mbình tăng + mH2 = 9,2 gam và nOH- = 2nH2 = 0,2 mol
Z là ancol đơn chức → Mancol = 9,2/0,2 = 46 (C2H5OH )
→ Y là HOC-COOC2H5
%Y = (0,2.102)/ (0,1.102 + 0,1.90).100%= 69,38%
→ Đáp án A

Quy đổi hỗn hợp X thành:
C 2 H 3 O N : 0 , 44 m o l T í n h t u n N 2 = 0 , 22 m o l C H 2 : a m o l H 2 O : b m o l
Trong phản ứng thủy phân X:
X + N a O H → M u o i + H 2 O
Khối lượng muối tăng so với X chính là lượng NaOH trừ đi lượng H 2 O
= > m N a O H – m H 2 O = 15 , 8 = > 40.0 , 44 – 18 b = 15 , 8 = > b = 0 , 1 m o l
Coi quá trình đốt cháy muối là quá trình đốt cháy X và NaOH ban đầu
n N a 2 C O 3 = n N a O H / 2 = 0 , 22 m o l
BTNT C => n C O 2 = 2 n C 2 H 3 O N + n C H 2 – n N a 2 C O 3 = 2.0 , 44 + a – 0 , 22
= > n C O 2 = a + 0 , 66 m o l
BTNT H = > n H 2 O = 1 , 5. n C 2 H 3 O N + n C H 2 + ½ . n N a O H
= > n H 2 O = 1 , 5.0 , 44 + a + 0 , 5.0 , 44 = > n H 2 O = a + 0 , 88
∑ m C O 2 + H 2 O = a + 0 , 66 .44 + a + 0 , 88 .18 = 56 , 04
=> a = 0,18 (mol)
=> m X = 0 , 44.57 + 0 , 18.14 + 0 , 1.18 = 29 , 4 g
Đặt x, y là số mol của A, B
∑ n X = x + y = b = 0 , 1 ∑ n NaOH = 4 x + 5 y = 0 , 44 = > x = 0 , 06 y = 0 , 04
Đặt u, v là số mol của glyxin và analin
∑ n N = u + v = 0 , 44 ∑ n C = 2 u + 3 v = n C O 2 + n N a 2 C O 3 = 1 , 06 = > u = 0 , 26 v = 0 , 18
A : G l y p A l a 4 − p : 0 , 06 m o l B . G l y q A l a 5 − q : 0 , 04 m o l
= > n G l y = 0 , 06 p + 0 , 04 q = 0 , 26
=> 3p + 2q = 13
Vì p ≤ 4 và q ≤ 5 => p = 3 và q = 2 thỏa mãn
= > B l à G l y 2 A l a 3
% m B = 0 , 04. 345 / 29 , 4 ] .100 % = 46 , 94 % gần nhất với 47,50%
Đáp án cần chọn là: D

Đáp án D
Quy đổi hỗn hợp X thành:
C2H3ON: 0,44 (mol) ( Tính từ nN2 = 0,22 mol)
CH2: a mol
H2O : b mol
Trong phản ứng thủy phân X:
X + NaOH → Muối + H2O
Khối lượng muối tăng so với X chính là lượng NaOH trừ đi lượng H2O
=> mNaOH – mH2O = 15,8
=> 40.0,44 – 18b = 15,8
=> b = 0,1 (mol)
Coi quá trình đốt cháy muối là quá trình đốt cháy X và NaOH ban đầu
nNa2CO3 = nNaOH/2 = 0,22 (mol)
BTNT C => nCO2 = 2nC2H3ON + nCH2 – nNa2CO3 = 2.0,44 + a – 0,22
=> nCO2 = a + 0,66 (mol)
BTNT H => nH2O = 1,5nC2H3ON +nCH2 + ½. nNaOH
=> nH2O = 1,5.0,44 + a + 0,5.0,44
=> nH2O = a + 0,88
∑ mCO2+H2O = (a + 0,66).44 + (a + 0,88).18 = 56,04
=> a = 0,18 (mol)
=> mX = 0,44.57 + 0,18.14 + 0,1.18 = 29,4 (g)
Đặt x , y là số mol của A, B
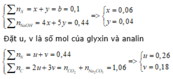
A: (Gly)P(Ala)4-p: 0,06 (mol)
B. (Gly)q(Ala)5-q : 0,04 (mol)
=> nGly = 0,06p + 0,04q = 0,26
=> 3p + 2q = 13
Vì p ≤ 4 và q ≤ 5 => p = 3 và q = 2 thỏa mãn
=> B là (Gly)2(Ala)3
%mB = [0,04. 345)/ 29,4].100% = 46,94% gần nhất với 47,50%

Đáp án D
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=>3x + 6z = 2y + 0,15 + 0,1 + 8t(1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=>t + 3x = 2z(2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13(3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=>1,36 = 32z – 16.(1,5x – y)(4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g
nNaHCO3 = 0,4 (mol)
BTNT C, có: nCO2 = nNaHCO3 = 0,4 (mol)
⇒ VCO2 = 0,4.22,4 = 8,96 (l)