Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
nCO2=0,15 mol, nBa(OH)2=0,125 mol
1<nOH-/nCO2=0,25/0,15=1,67<2 => Tạo 2 muối
BaCO3: x
Ba(HCO3)2: y
x+y=nBa2+=0,125
x+2y=nC=0,15
=>x=0,1; y=0,025
CM Ba(HCO3)2=0,025/0,125=0,2M

Đáp án B
► Xét TN1: đặt nCO32– phản ứng = a; nHCO3– phản ứng = b.
⇒ nCO2 = a + b = 0,15 mol; nHCl phản ứng = 2a + b = 0,1875 mol
||⇒ giải hệ có: a = 0,0375 mol; b = 0,1125 mol ⇒ nCO32–/X : nHCO3–/X = a : b = 1 : 3.
► Xét TN2: ∑nC/X = n↓ = 0,25 mol ⇒ 250 ml X chứa 0,5 mol C.
Bảo toàn nguyên tố Cacbon: y = 0,5 – 0,25 = 0,25 mol.
● Chia 0,5 mol C thành 0,125 mol CO32– và 0,375 mol HCO3–.
Bảo toàn điện tích: nK+ = 0,625 mol. Bảo toàn nguyên tố Kali:
x = 0,625 – 0,25 × 2 = 0,125 mol

Đáp án D
Na2CO3 : x mol , KHCO3 : y mol
→
0
,
15
m
o
l
H
C
l
CO2 0,045 mol và dung dịch Y
→
d
u
+
B
a
(
O
H
)
2
0,15 mol BaCO3
Nhận thấy khi cho dung dịch Ba(OH)2 vào dung dịch Y thấy tạo kết tủa → Y có HCO3-
Bảo toàn nguyên tố C → x + y = nBaCO3 + nCO2 = 0,195 (1)
Bảo toàn điện tích trong dung dịch Y (Na+ 2x mol, K+ y mol, HCO3- dư 0,15 mol , Cl- : 0,15 mol): 2x+ y= 0,3 (2)
Giải 2 phương trình (1) và (2) : x= 0,105 và y = 0,09
Vậy CMNa2CO3= 0,21M, CMKHSO3 = 0,18M. Đáp án D

Đáp án A
Ta có: n C O 2 = 0,35 mol; nNaOH = 0,2.2 = 0,4 mol
→ T = n N a O H n C O 2 = 0 , 4 0 , 35 = 1 , 14
→ Tạo 2 muối
CO2+ NaOH → NaHCO3
x x x mol
CO2+ 2NaOH →Na2CO3+ H2O
y 2y y mol
Ta có: n C O 2 = x+y = 0,35 mol; nNaOH = x+2y = 0,4 mol
→x = 0,3 và y = 0,05
Dung dịch X chứa 0,3 mol NaHCO3 và 0,05 mol Na2CO3
Trong 100 ml dung dịch Y có: nHCl = 0,1 mol; n H 2 S O 4 = 0,1x mol
→ n H + = 0,1+ 0,2x mol; n S O 4 2 - = 0,1x mol
Cho từ từ 100 ml dung dịch Y vào 200 ml dung dịch X thu được n C O 2 = 0,25 mol
H++ CO32- → HCO3-
0,05←0,05→ 0,05
H+ + HCO3- → CO2+ H2O
0,25 0,25← 0,25 mol
Ta có:
n H + = 0,05+ 0,25 = 0,1+ 0,2x → x = 1 mol/l
Dung dịch Z có chứa Na+ ; HCO3- ; SO42-: 0,1x = 0,1 mol
Ba2+ + SO42- → BaSO4 ↓
n B a S O 4 = n S O 4 2 - = 0,1 mol → m B a S O 4 = 0,1.233 = 23,3 gam

Đáp án B
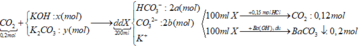
TH1: Nếu trong dd X có OH- dư => dd X chứa OH- dư, CO32-, K+
Khi cho từ từ 100 ml dd X vào 0,15 mol HCl
OH- + H+ → H2O
CO32- + 2H+ → CO2 ↑+ H2O
=> nH+ = nOH- + 2nCO2 > 0,12.2 = 0,24 (mol)
=> loại vì nH+ = 0,15 (mol)
Vậy dd X không chứa OH- dư
TH2: dd X không chứa OH- dư ta có sơ đồ bài toán như trên
Khi cho từ từ 100ml dd X vào 0,15 mol HCl có phản ứng:
HCO3- + H+ → CO2 + H2O
x → x →x (mol)
CO32- + 2H+ → CO2 + H2O
y → 2y → y (mol)

=> a – 3b = 0 (1)
BTNT C: nBaCO3 = a + b = 0,2 (2)
Từ (1) và (2) => a = 0,15 và b = 0,05 (mol)
Trong 200 ml dd X : nHCO3- = 0,3 (mol) ; nCO32- = 0,1 (mol)
Bảo toàn điện tích đối với dd X : nK+ = 0,3 + 0,1.2 = 0,5 (mol)
BTNT C: nCO2(bđ) + nK2CO3 = nHCO3-+ nCO32- => 0,2 + y = 0,3 + 0,1 => y = 0,2 (mol)
BTNT K: nK+ = nKOH + 2nK2CO3 => nKOH = 0,5 – 2.0,2 = 0,1 (mol)
=> x = 0,1 (mol)

Đáp án A
X có công thức đơn giản nhất mà C3H5O2 ⇒X có dạng (C3H5O2)n
+ n =1 ⇒ Không có công thức nào thỏa mãn.
+ n = 2 ⇒ X có CTPT C6H10O4
⇒ X là C4H8(COOH)2 .
⇒ nCO2 = 2nX = 2. 0,1 . 0,1 = 0,02
⇒ V = 0,02 . 22,4 = 0,448 = 448l.

CT ĐGN của axit là C3H5O2 => CTPT là C6H10O4 hay C4H8(COOH)2
C4H8(COOH)2 +2NaHCO3 → C4H8(COONa)2 + 2CO2 + 2H2O
0,01 mol → 0,02 mol
=>V = 0,02.22,4 = 0,448 lít = 448 ml =>Chọn C
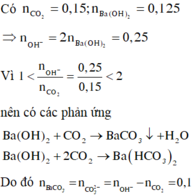
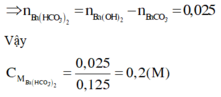
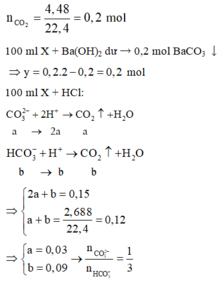
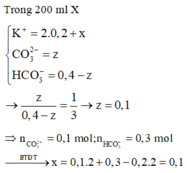
\(n_{HCl}=\dfrac{3,36}{22,4}=0,15\left(mol\right);n_{AgNO_3}=\dfrac{100.1,1.8\%}{170}=\dfrac{22}{425}\left(mol\right)\)
\(AgNO_3+HCl\rightarrow AgCl+HNO_3\)
Lập tỉ lệ: \(\dfrac{22}{425}< \dfrac{0,15}{1}\Rightarrow\)Sau phản ứng HCl dư
\(n_{HNO_3}=n_{AgNO_3}=\dfrac{22}{425}\left(mol\right)\\ m_{ddsaupu}=0,15.36,5+100.1,1-\dfrac{22}{425}.143,5=108,05\left(g\right)\)
\(C\%_{HNO_3}=\dfrac{\dfrac{22}{425}.63}{108,5}.100=3,02\%\)