

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

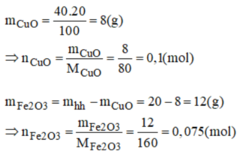


mFe2O3 =\(\dfrac{75.16}{100}=12g\)
nFe2O3=12/160=0,075mol
mCuO=16-12=4g
nCuO=4/80=0,05mol
pt : Fe2O3 + 3H2 -----> 2Fe + 3H2O
npứ:0,075--->0,225(1)
mFe=0,15.8,4g
pt : CuO + H2 ------> Cu + H2O
npứ:0,05-->0,05(2)
mCu = 0,05.64=3,3g
từ pt (1),(2) ta có nH2 =0,05 + 0,225=0,275mol
VH2 =0,275.22,4=6,16l

Câu 5:
PTHH : H2+ Cl2 -to-> 2 HCl
Vì số mol , tỉ lệ thuận theo thể tích , nên ta có:
25/1 = 25/1 => P.ứ hết, không có chất dư, tính theo chất nào cũng được
=> V(HCl)= 2. V(H2)= 2. 25= 50(l)
Câu 4: mFe2O3= 0,6. 80= 48(g)
=> nFe2O3= 48/160=0,3(mol)
mCuO= 80-48=32(g) => nCuO=32/80=0,4(mol)
PTHH: CuO + CO -to-> Cu + CO2
0,4_______0,4_____0,4____0,4(mol)
Fe2O3 + 3 CO -to-> 2 Fe +3 CO2
0,3_____0,9____0,6______0,9(mol)
=>nCO= 0,4+ 0,9= 1,3(mol)
=> V(CO, đktc)= 1,3. 22,4=29,12(l)

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

Đặt nFe2O3=a
nCuO=b
Ta có:
\(\left\{{}\begin{matrix}160a+80b=32\\112a+64b=24\end{matrix}\right.\)
=>a=0,1;0,2
mFe2O3=160.0,1=16(g)
mCuO=32-16=16(g)
nO=0,1.3+0,2=0,5(mol)
Ta có:
nO=nH2=0,5(mol)
VH2=22,4.0,5=11,2(lít)

a, Ta có PTHH :
\(CuO+H_2\rightarrow Cu+H_2O\) ( I )
\(Fe_2O_3+3H_2\rightarrow2Fe+H_2O\) ( II )
\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\) ( III )
b, \(n_{H2O}=\frac{m_{H2O}}{M_{H2O}}=\frac{14,4}{1.2+16}=\frac{14,4}{18}=0,8\left(mol\right)\)
Mà \(n_{\left(H\right)}=2.n_{H2O}=2.0,8=1,6\left(mol\right)\)
=> \(n_{H2}=\frac{1}{2}.n_{\left(H\right)}=\frac{1,6}{2}=0,8\left(mol\right)\)
-> \(V_{H2}=n_{H2}.22,4=0,8.22,4=17,92\left(l\right)\)