Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có :
\(\text{nCuSo4 = 0,1}\)
\(\text{nH2O = 8}\)
\(\text{=> Tổng số mol nguyên tử = 0,1.6 + 8.3= 24.6 }\)
=> Số mol nguyên tử thoát ra = 24,6/2 =12/3
=> nH2O thoát ra = 12,3/3= 4,1
\(\text{=>mH2O thoát ra = 73,8}\)
Theo đề bài ta có :
mCuSO4 = 160 . 10% = 16 (g)
=> nCuSO4 = 16 : 160 = 0,1 (mol)
=> số nguyên tử có trong 0,1 Mol CuSO4 là :
0,1 . (1 + 1 + 4) . 6 . \(10^{23}\) = 3,6 . 10\(^{23}\)(nguyên tử)
mH2O (dd) = 160 - 16 = 144 (g)
=> nH2O = 8 (mol)
=> số nguyên tử có trong 8 mol H2O là :
8 . (2 + 1) . 6 . 10\(^{23}\) = 144 . 10\(^{23}\)(nguyên tử)
=> tổng số nguyên tử có trong dung dịch là :
144 . 1023 + 3,6 . 10\(^{23}\)= 147,6 . 10\(^{23}\) (nguyên tử )
=> số nguyên tử nước thoát ra là :
147,6 . 10\(^{23}\): 2 = 73,8 . 10\(^{23}\)(nguyên tử)
=> nH2O (thoát ra) = 4,1 (mol)
=> mH2O (thoát ra ) = 4,1 . 18 = 73,8 (g)
Vậy khối lượng nước bay ra là : 73,8 (g)

Số mol CuSO 4 = 10/100 = 0,1 mol
Phương trình hóa học của phản ứng:
Fe + CuSO 4 → FeSO 4 + Cu
Khối lượng Fe phản ứng: 0,1 . 56 =5,6(gam)
Khối lượng Cu sinh ra: 0,1 . 64 = 6,4 (gam)
Gọi x là khối lượng lá sắt ban đầu
Khối lượng lá sắt khi nhúng vào dung dịch CuSO 4 tăng lên là: 4x/100 = 0,04x (gam)
Khối lượng lá sắt tăng lên = m Cu sinh ra - m Fe phản ứng = 0,04x = 6,4 -5,6 = 0,8
=> x= 20 gam

Nhận thấy: Đốt cháy A và đốt cháy Y cần thể tích khí O2 là như nhau. Ta có
BTNT C: nCO2 = nCO2 + nNa2CO3 = 0,4
BTKL: mA + mO2 = mCO2 + mH2O
=> mH2O = 7,2g

Gọi a là số mol C u S O 4 tham gia phản ứng
Phương trình hóa học:
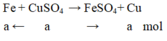
Theo đề bài ta có: m C u b á m v à o – m F e tan r a = m K L t ă n g
64a – 56a = 0,8 ⇒ a = 0,01 mol
Nồng độ dung dịch C u S O 4 là: C M = n V = 0,01 0,2 = 0,5 M
⇒ Chọn C.

Fe + CuSO4 → FeSO4 + Cu
1mol 1 mol => tăng 8 gam
x mol x mol tăng 0,8gam
=> x= 0,8:8= 0,1 mol
=> CM ( dung dịch CuSO4) = 0,1:0,2= 0,5 M
Bài 3 :
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu|\)
1 1 1 1
x 0,1 x
Gọi x là số mol của Fe
Vì khối lượng của sắt tăng so với ban đầu nên ta có phương trình :
\(m_{Cu}-m_{Fe}=0,8\left(g\right)\)
64x - 56x = 0,8
8x = 0,8
⇒x = \(\dfrac{0,8}{8}=0,1\)
\(n_{CuSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddCuSO4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt

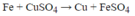
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam khối lượng dung dịch giảm so với ban đầu 0,8 gam

2Na +2HCl--> 2NaCl + H2 (1)
2Na +2H2O --> 2NaOH +H2 (2)
3NaOH +AlCl3 --> 3NaCl +Al(OH)3 (3)
có thể : NaOH +Al(OH)3 --> NaAlO2 +2H2O (4)
a) nH2=0,6(mol)
nAl(OH)3=0,1(mol)
nAlCl3 =0,25(mol)
xét 2 trường hợp :
TH1: AlCl3 dư => ko có (4)
theo (3) : nNaOH =3nAl(OH)3=0,3(mol)
theo (2) : nNa(2)=nNaOH=0,3(mol)
nH2(2)=1/2nNaOH=0,15(mol)
=> nH2(1) =0,45(mol)
theo (1) : nNa(1)=nHCl=2nH2(1)=0,9(mol)
=>a=1,8(M)
\(\Sigma\)nNa=1,2(mol)
=>m=27,6(g)
TH2 : AlCl3 hết => có (4)
theo (4) : nNaOH(4) =nAl(OH)3=0,1(mol)
theo (3) : nNaOH(3)=3nAlCl3=0,75(mol)
=>\(\Sigma\)nNaOH=0,85(mol)
theo (2) : nNa(2)=nNaOH=0,85(mol)
nH2(2)=1/2nNaOH=0,425(mol)
=> nH2(1)=0,175(mol)
theo (1) : nNa(1)=nHCl=2nH2(1)=0,35(mol)
=>\(\Sigma\)nNa=1,2(mol)
=>m=27,6(g)
a=0,7(M)
b) CO2 +2H2O +NaAlO2 --> NaHCO3 +Al(OH)3 (5)
nCO2=0,2(mol)
theo (4) : nNaAlO2=nAl(OH)3=0,1(mol)
lập tỉ lệ :
\(\dfrac{0,2}{1}>\dfrac{0,1}{1}\)
=> CO2 dư ,NaAlO2 hết => bài toán tính theo NaAlO2
theo (5) : nAl(OH)3 (5)=nNaAlO2=0,1(mol)
=> mAl(OH)3=7,8(g)

Theo đề bài: cho A phản ứng với dung dịch NaOH thu được glixerol và 2 muối của 2 axit đơn chức, A chỉ chứa 1 loại nhóm chức
=> A là este 3 chức phản ứng với NaOH theo tỷ lệ mol 1:3 tạo ra 0,02 mol glixerol nên tiêu thụ 0,06 mol NaOH, tạo ra 0,04 mol 1 muối và 0,02 mol muối còn lại.
A + 3NaOH → C3H5(OH)3 + 2R1COONa + R2COONa
0,06 ← 0,02 → 0,04 → 0,02
=> nNaOH dư = 0,025.4 – 0,06 = 0,04 mol
Ta lại có: Axit X ít hơn Y 2 nguyên tử C và có cùng số nguyên tử H.
=> Gọi CTPT của các muối của X, Y với số mol tương ứng là CnHmCOONa x mol và Cn+2HmCOONa y mol.
Bảo toàn Na ta có:
nNa2CO3 = 1/2nNaOH bđ = 0,05 mol
Dẫn hỗn hợp khí và hơi sau khi đốt cháy B vào dung dịch Ba(OH)2 dư thì xảy ra phản ứng: Ba(OH)2 + CO2 → BaCO3 + H2O
=> nCO2 = nBaCO3 = 195,03/197 = 0,99 mol
Bảo toàn C ta có (n+1)x + (n+3)y = 0,05 + 0,99 =1,04 (*)
Xét 2 trường hợp có thể có với este A.
Trường hợp 1: A chứa 2 gốc axit X và 1 gốc axit Y
=> x = 0,04 mol, y = 0,02 thay vào (*) thì n = 15,67 vô lí (loại).
Trường hợp 2: A chứa 2 gốc axit Y và 1 gốc axit X
=> x = 0,02 mol, y = 0,04 mol thay vào (*) thì n =15
Khi đó 19,24 gam hỗn hợp B gồm: C15HmCOONa 0,02 mol, C17HmCOONa 0,04 mol và NaOH dư 0,04 mol.
=> 0,02(247 + m) + 0,04(271 + m) + 0,04 . 40 = 19,24
=> m = 31 (thỏa mãn)
=> 2 muối thu được là C15H31COONa và C17H31COONa
Este A có dạng:
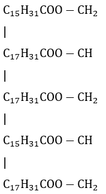
CTPT của A là C55H98O6
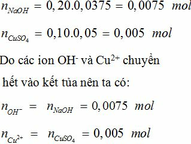

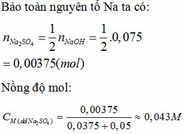
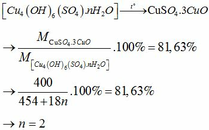
Theo đề bài ta có :
mCuSO4 = 160 . 10% = 16 (g)
=> nCuSO4 = 16 : 160 = 0,1 (mol)
=> số nguyên tử có trong 0,1 Mol CuSO4 là :
0,1 . (1 + 1 + 4) . 6 . 1023 = 3,6 . 1023 (nguyên tử)
mH2O (dd) = 160 - 16 = 144 (g)
=> nH2O = 8 (mol)
=> số nguyên tử có trong 8 mol H2O là :
8 . (2 + 1) . 6 . 1023 = 144 . 1023 (nguyên tử)
=> tổng số nguyên tử có trong dung dịch là :
144 . 1023 + 3,6 . 1023 = 147,6 . 1023 (nguyên tử )
=> số nguyên tử nước thoát ra là :
147,6 . 1023 : 2 = 73,8 . 1023 (nguyên tử)
=> nH2O (thoát ra) = 4,1 (mol)
=> mH2O (thoát ra ) = 4,1 . 18 = 73,8 (g)
Vậy khối lượng nước bay ra là : 73,8 (g)