Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho hỗn hợp X vào H2SO4 thu được (a+b)g --> hh X gồm oxit kim loại A và kim loại B
Trong đó: oxit kim loại A ko bị khử bởi CO, kim loại B ko tan trong d.d H2SO4
-->Dễ suy ra kim loại B là Cu
(*)Giả sử oxit kim loại A là AO
AO+H2SO4-->ASO4+H2O
1..........1..........1 mol
m d.d sau pư=A+16+980=A+996 g
C% ASO4=11,765%
\(\Rightarrow\frac{A+96}{A+996}=0,11765\)
\(\Rightarrow A=24\left(Mg\right)\)
(*) Giả sử là A2O3 làm tương tự -->loại
Nếu ko chia trường hợp thì gọi là A2Ox hoặc AxOy

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
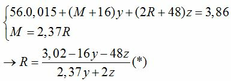
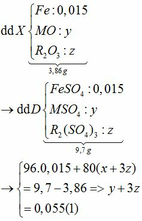
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

a./ Khối lượng H2SO4: m(H2SO4) = 15,3.90% = 13,77g
Khối lượng dd axit sau khi hấp thụ H2O: m(dd sau) = 13,77/86,34% gam
Khối lượng H2O bị hấp thụ: m(H2O ht) = m(dd sau) - m(dd đầu) = 13,77/86,34% - 15,3
Khối lượng H2O tạo ra từ phản ứng khử MO:
m(H2O) = m(H2O ht)/90% = [13,77/86,34% - 15,3]/90% = 0,72g
→ n(H2O) = 0,72/18 = 0,04mol
H2 + MO → M + H2O
___________0,04__0,04
M = 2,56/0,04 = 64
→ kim loại M cần tìm là Cu
b./ Gọi x, y là số mol của MgO và Al2O3 có trong hh A
Số mol CuO có trong hh A: n(CuO) = 0,04/80% = 0,05mol
m(hh A) = m(MgO) + m(Al2O3) + m(CuO) = 40x + 102y + 0,05.80 = 16,2g
Số mol CuO có trong hh chất rắn sau pư với H2: n(CuO sau) = 0,05-0,04 = 0,01mol
Cho hh chất rắn tác dụng với HCl
MgO + 2HCl → MgCl2 + 2H2O
x______________x
Al2O3 + 6HCl → 2AlCl3 + 3H2O
y_______________2y
CuO + 2HCl → CuCl2 + 2H2O
0,01__________0,01
Lấy 1/20 dung dịch B tác dụng với NaOH dư
AlCl3 + 4NaOH → NaAlO2 + 3NaCl + 2H2O
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
x/10______________x/10
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
0,001_____________0,001
Nung kết tủa đến khối lượng không đổi
Mg(OH)2 → MgO + H2O
x/10_______x/10
Cu(OH)2 → CuO + H2O
0,001_____0,001
m(oxit) = m(MgO) + m(CuO) = 40.x/10 + 0,001.80 = 0,28g
→ x = 0,05mol → y = (16,2 - 0,05.40 - 0,05.80)/102 = 0,1mol
Khối lượng mỗi oxit trong A
m(MgO) = 0,05.40 = 2g; m(Al2O3) = 0,1.102 = 10,2g; m(CuO) = 0,05.80 = 4g
Phần trăm khối lượng mỗi oxit
%MgO = 2/16,2 .100% = 12,36%
%Al2O3 = 10,2/16,2 .100% = 62,96%
%CuO = 4/16,2 .100% = 24,68%
Câu b của bạn Hậu Duệ Mặt Trời chép mạng và nó sai hoàn toàn.

O2 + C → t ∘ dư 2CO
Khí X là CO
Khi cho CO qua Al2O3 và Fe2O3 chỉ có Fe2O3 bị CO khử
Fe2O3 + 3CO → t ∘ 2Fe + 3CO2↑
Khí Y là CO2
Hỗn hợp rắn Z: Fe, Al2O3, có thể có Fe2O3 dư
Khí Y + Ca(OH)2 dư chỉ tạo ra muối trung hòa
CO2 + Ca(OH)2 → CaCO3↓trắng + H2O
Cho hỗn hợp Z vào H2SO4 loãng dư, không thấy có khí thoát ra => trong Z chắc chắn có Fe2O3 dư
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O

1./ Dẫn luồng khí H2 qua ống đựng CuO:
CuO + H2 → Cu + H2O
a a a
Khối lượng chất rắn giảm:
Δm = m(CuO pư) - m(Cu) = 80a - 64a = 80 - 72,32 = 7,68g
⇒ a = 7,68/16 = 0,48g
Số mol H2 tham gia pư: n(H2) = 0,48/80% = 0,6mol
Theo ĐL bảo toàn nguyên tố, số mol HCl tham gia pư là: n(HCl pư) = 2.n(H2) = 1,2mol
Theo ĐL bảo toàn khối lượng:
m(hh rắn) + m(HCl pư) = m(muối) + m(H2) ⇒ m(muối) = m(hh rắn) + m(HCl pư) - m(H2)
⇒ m(muối) = 65,45 + 0,12.36,5 - 0,6.2 = 108,05g
Gọi x, y là số mol Al và Zn có trong hh KL ban đầu.
m(hh KL) = m(Al) + m(Zn) = 27x + 65y = 40,6g
m(muối) = m(AlCl3) + m(ZnCl2) = 133,5x + 136y = 108,05g
⇒ x = 0,3mol và y = 0,5mol
Khối lượng mỗi kim loại:
m(Al) = 0,3.27 = 8,1g; m(Zn) = 65.0,5 = 32,5g
Thành phần % khối lượng mỗi kim loại:
%Al = 8,1/40,6 .100% = 19,95%
%Zn = 32,5/40,6 .100% = 80,05%
