Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi a, b là CM của H2SO4, NaOH.
+ TN1: NaOH pứ hết, H2SO4 dư
nH2SO4 = 0.12a => nH+ = 0.24a
nNaOH = 0.04b => nOH- = 0.04b
nH2SO4 dư = 0.1*(0.12 + 0.04) = 0.016 => nH+ dư = 0.032
2H+ ... +.... OH- + SO4(2-) -----> HSO4- + H2O
0.08b.........0.04b
nH+ dư = 0.24a - 0.08b = 0.032 (1)
+ TN2: H2SO4 pứ hết, NaOH dư
nH2SO4 = 0.04a => nH+ = 0.08a
nNaOH = 0.06b => nOH- = 0.06b
nNaOH dư = 0.16*(0.04 + 0.06) = 0.016 => nOH- dư = 0.016
H+ + OH- ------> H2O
0.08a....0.08a
=> nOH- dư = 0.06b - 0.08a = 0.016 (2)
Từ (1) và (2) => a = 0.4, b = 0.8
có phải là lp 6 thiệt ko, hơi bj nghi ngờ đó, hóa lp 8 chứ ko ít

2NaOH + H2SO4 → Na2SO4 + 2H2O
\(n_{NaOH}=\dfrac{16}{40}=0,4\left(mol\right)\)
a) Theo PT: \(n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}\times0,4=0,2\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{0,2}{2}=0,1\left(l\right)=100\left(ml\right)\)
b) Theo PT: \(n_{Na_2SO_4}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}\times0,4=0,2\left(mol\right)\)
\(\Rightarrow m_{Na_2SO_4}=0,2\times142=28,4\left(g\right)\)
c) \(C_{M_{Na_2SO_4}}=\dfrac{0,2}{0,1}=2\left(M\right)\)

1. Trong 4 kim loại trên, không có kim loại nào tác dụng được với cả 4 dung dịch trên.
2. Chúng ta có thể dùng nước vôi trong để loại bỏ các khí độc trên là tốt nhất.
PTHH: Ca(OH)2 + 2H2S ===> 2H2O + Ca(HS)2
Ca(OH)2 + CO2 ===> CaCO3 + H2O
Ca(OH)2 + SO2 ===> CaSO3 + H2O
2Ca(OH)2 + 2Cl2 ===> CaCl2 + Ca(ClO)2 + 2H2O
3. Các cặp dung dịch không tác dụng được với nhau là:
+) Dung dịch HNO3 và dung dịch BaCl2
4. Những cặp chất sau đây tác dụng được với nhau là:
+) Al và dung dịch KOH

A. Ta có pt: \(SO_3+H_2O\rightarrow H_2SO_4\)
Theo pt, 1 : 1 \(\rightarrow\) 1
Gọi n\(SO_3\) = x(mol) \(\rightarrow\) n\(H_2SO_4\) = x(mol)
\(\rightarrow mH_2SO_4=98x\)(g)
Cách 1: Trong 100g dung dịch \(H_2SO_4\) 20% có lượng \(H_2SO_4\) là: 100.20% = 20g.
Suy ra lượng \(H_2SO_4\) trong dung dịch \(H_2SO_4\) 10% là 20 - 98x (g)
Suy ra mdd\(H_2SO_4\) 10% là (20 - 98x) : 10%
Theo bài ra, ta có: 98x + (20 - 98x) : 10% = 100
Giải ra ta được x xấp xỉ 0,11
Vậy m\(SO_3\) = 0,11.(32 + 3.16) = 8,8g.
Cách 2: Áp dụng sơ đồ đường chéo:
Công thức: Gọi \(C_1,C_2,C\) lần lượt là nồng đồ phần trăm của chất thứ nhất, thứ hai và sau phản ứng
\(m_1,m_2,m\) là khối lượng của chất thứ nhất, thứ hai và sau phản ứng. Khi đó ta có:
\(m=m_1+m_2\);
\(\dfrac{\left|C_1-C\right|}{\left|C-C_2\right|}=\dfrac{m_1}{m_2}\)
Nồng đồ phần trăm của chất tan là 100%, của nước là 0%.
Như vậy, \(\dfrac{\left|100-20\right|}{\left|20-10\right|}=\dfrac{a}{100-a}\) (với a là m\(H_2SO_4\))
Vậy a xấp xỉ 11,1g
Suy ra n\(H_2SO_4\) xấp xỉ 0,11mol
Vậy m\(SO_3\) = 0,11.(32 + 3.16) = 8,8g.
P/s: Cái phương pháp sơ đồ đường chéo là nó thế này bạn:
(Mình vẽ không được đẹp lắm :))
Câu B bạn làm tương tự
C 1 2 C C C C C C 1 2 m 1 m 2
Cái chỗ a ý, phải là \(\dfrac{\left|10-20\right|}{\left|100-20\right|}=\dfrac{a}{100-a}\) nhé
Cả chỗ trên phần công thức cũng thế, phải là \(\dfrac{\left|C_2-C\right|}{\left|C-C_1\right|}\)

m Mg = 4,8 g => n Mg = 0,2 mol
Mg + H2SO4 -> MgSO4 + H2
0,2 0,2 0,2
=> m H2SO4 = 0,2 . 98 = 19,6g
=> m dd H2SO4 = \(\frac{19,6.100\%}{24,5\%}=80g\)
m dd sau pứ = m dd H2SO4 = 80g
=> C% dd muối = \(\frac{0,2.120.100\%}{80}\)= 30%
#mã mã#



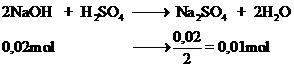


nồng dộ của dung dịch H2SO4 và NaOH là a và b,ta có
H2SO4 + 2NaOH = Nà2SO4 + 2H2O
0,02a--------0,04a
=>0,04a=0,06b
H2SO4+2NaOH=Na2SO4+2H2O
0,01b/2---0,01b
H2SO4+BaCO3=BaSO4+H2O+CO2
0,03--------0,03
=>0,02a-0,01b/2=5,91/197=0,03
=>a=1,8 và b=1,2
kết quả của câu này là 1,5M và 1M