Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MSO4 + Ba(NO3)2 => BaSO4 + M(NO3)2
0,1 <--------------------- 0,1
nBaSO4 = 0,1mol
MSO4 + 2NaOH => Na2SO4 + M(OH)2
0,1-------------------------------------> 0,1
MM(OH)2= \(\frac{9}{0,1}\) = 90 => M=56 => Fe
=> công thức FeSO4.nH2O
n tinh thể = nFeSO4 = 0,1
=> M tinh thể = 27,8/0,1= 278
<=> 152 + 18n = 278 => n= 7
=> FeSO4.7H2O

Theo đề bài ta có :
nBaCO3 = \(\dfrac{3,94}{197}=0,02\left(mol\right)\)
nHCl = 0,4.0,5 = 0,2 (mol)
Ta có PTHH :
BaCO3 + 2HCl \(\rightarrow\) BaCl2 + H2O + CO2\(\uparrow\)
0,02mol....0,04mol
Theo PTHH ta có tỉ lệ :
nBaCO3 = \(\dfrac{0,02}{1}mol< nHCl=\dfrac{0,2}{2}mol\)
=> Số mol của của HCl dư ( tính theo số mol của BaCO3)
=> nHCl (dư) = 0,2- 0,04 = 0,16 (mol)
Giả sử số mol của dung dịch 0,5 M = số mol của HCl dư
=> Vdd\(_{\left(c\text{ần}-\text{đ}\text{ể}-trung-h\text{òa}-l\text{ư}\text{ợng}-HCl-d\text{ư}\right)}=\dfrac{0,16}{0,5}=0,32\left(l\right)=320\left(ml\right)\)
Vậy.....
Bạn ko nói rõ là dùng dd nào để trung hòa axit dư nên tôi lấy bazo thông dụng là NaOH.
nBaCO3= 3.94/197=0.02 mol
nHCl= 0.4*0.5=0.2 mol
PTHH : BaCO3 +2HCl ---> BaCl2 + CO2 + H2O
0.02......0.2
=> HCl dư 0.08 mol
PTHH : HCl + NaOH ---> NaCl + H2O
0.08.....0.08
=>VNaOH = 0.08/0.5=0.16l=160ml

đặt nồng độ mol của dd a là a , dd b la b. khi trộn 3 l a (có 3a mol) với 2 lit b (có 2b mol) được 5 lit dd x có dư axit. trung hoà 5 lit dd x cần
nKOH =0,2.5 = 1mol -> số mol H2SO4 dư: 0,5 mol.
H2SO4+ 2KOH -> K2SO4 +2 H2O
b-------------- 2b
số mol h2so4 dư = 3a – b = 0,5*
trộn 2l dd a (có 2a mol) với 3 lít ddb (có 3b mol) tạo 5 l dd y có koh dư. trung hoà 5 lit y cần 0,2 .5 = 1 mol hcl
pt: H2SO4 + 2KOH -> K2SO4 + 2H2O
2a---------------- 4a
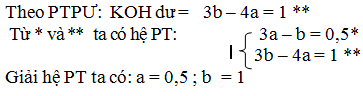

B1:
2NaOH+H2SO4\(\rightarrow\)Na2SO4+2H2O
nNaOH=\(\frac{4}{40}=0.1\)mol
=>nH2SO4=\(\frac{1}{2}\)nNaOH=0.05 mol
=>CM=\(\frac{n_{H2SO42}}{V}\)=\(\frac{0.05}{200}\)=2,5.10-4 (M)
B2:
Mg+\(\frac{1}{2}\)O2\(\underrightarrow{t^0}\)MgO (1)
MgO+2HCl\(\rightarrow\)MgCl2+H2O (2)
nMg(1)=\(\frac{0,36}{24}=0,015mol\)
=>nMgO(1)=0,015=nMgO(2)
nHCl(2)=2nMgO(2)=0,03mol
=>CM(HCl)=\(\frac{n_{HCl}}{V}=\frac{0,03}{100}=3.10^{-4}M\)

a có:
nNO=0,05(mol) ;nH2=0,4(mol) và mZ=2,3(g)
Muối sunfat trug hòa có thể gồm FeSO4 , Fe2(SO4)3 , (NH4)2SO4, K2SO4, Al2(SO4)3
áp dụng định luật bảo toàn khối lượng
66,2 + 3,1.136=466,6+0,45.469 + mH2O → mH2O=18,9(g) → nH2O=1,05(mol)
Đặt nNH4+=x(mol). Ta có 3,1=4x+2.1,05 + 2.0,4 → x= 0,05(mol)
Vậy nNO3=0,05+0,05=0,1(mol) → nFe(NO3)2=0,05(mol)
Bảo toàn nguyên tố O ta được 4a + 0,05.6 =1,05 + 0,05
a=0,2(mol) (Với a=nFe3O4)
=>mAl =66,2-0,2.232-180.0,05 =10,8(g)
%Al = 16,1%.

a có:
nNO=0,05(mol) ;nH2=0,4(mol) và mZ=2,3(g)
Muối sunfat trug hòa có thể gồm FeSO4 , Fe2(SO4)3 , (NH4)2SO4, K2SO4, Al2(SO4)3
áp dụng định luật bảo toàn khối lượng
66,2 + 3,1.136=466,6+0,45.469 + mH2O → mH2O=18,9(g) → nH2O=1,05(mol)
Đặt nNH4+=x(mol). Ta có 3,1=4x+2.1,05 + 2.0,4 → x= 0,05(mol)
Vậy nNO3=0,05+0,05=0,1(mol) → nFe(NO3)2=0,05(mol)
Bảo toàn nguyên tố O ta được 4a + 0,05.6 =1,05 + 0,05
a=0,2(mol) (Với a=nFe3O4)
=>mAl =66,2-0,2.232-180.0,05 =10,8(g)
%Al = 16,1%.

\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+H_2O\)
\(a\) \(2a\)
\(H_2SO_4+2KOH\rightarrow K_2SO_4+H_2O\)
\(b\) \(2b\)
Sau pư (1) đổi màu quỳ tìm \(\Rightarrow H_2SO_4\) dư \(n_{KON}=0,02.0,5=0,01\left(mol\right)\)
\(\rightarrow n_{H_2SO_4dư}=\frac{1}{2}n_{KOU}=5.10^{-3}\left(MOL\right)\)
\(\rightarrow n_{H_2O_4\text{ban đầu }}=0,05.1=0,05\left(mol\right)\)
\(\rightarrow n_{H_2SO_4\left(\text{pư 1 }\right)}=0,05-5.10^{-3}=0,045\left(mol\right)\)
\(\rightarrow n_{NaOH}=0,045.2=0,09\left(mol\right)\)
\(\rightarrow CM_{NaOH}=\frac{0,09}{0,05}=1,8\left(M\right)\)
Đây là phản ứng phân ly giữa một muối của một acid yếu (HALO2) với một acid mạnh (HCL). HALO2.H2O = Al(OH)3
Ta có phản ứng:
NaALO2 + HCL + H2O = NaCL + AL(OH)3 (1)
AL(OH)3 tiếp tục phản ứng với HCL:
3HCL + AL(OH)3 = ALCL3 + 3H2O (2)
Từ (1) và (2) ta có phản ứng:
NaAlO2 + 4HCL = ALCL3 + NaCL + 2H2O