Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

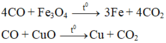
![]()
Khí thoát ra khỏi bình dẫn qua dung dịch Ca OH 2 thu được 5 gam kết tủa CaCO 3
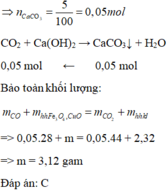

CO2 + Ca(OH)2 ---> CaCO3 + H2O
0,1 <--- 0,1
nCaCO3 = 10 / 100 = 0,1 ( mol )
Bảo toàn nguyên tố C => nCO2 = 0,1 ( mol )
=> n(O) trong oxit sắt = 0,1 ( mol )
Ta có :
mFe = 12,8 - 0,1.16 = 11,2 (g)

Gọi x là nồng đọ phần trăm của dung dịch B
thì nồng độ phần trăm của dung dịch A là 3x
Nếu KL của dung dịch B là m gam
thì KL của dung dịch A là 2,5m gam
KL NaOH có trong m gam dung dịch B = mx gam
KL của NaOH có trong 2,5m gam dung dịch A = 2,5.m.3x =7,5 mx gam
=> KL của NaOH có trong dd C = mx + 7,5mx = 8,5mx gam
KL dd C = m + 2,5m = 3,5m
=> 8,5mx/3,5m = 20/100
=> mx = 8,24%
=>C% dd A = 24,72%; C% B= 8,24%

Cho hỗn hợp X vào H2SO4 thu được (a+b)g --> hh X gồm oxit kim loại A và kim loại B
Trong đó: oxit kim loại A ko bị khử bởi CO, kim loại B ko tan trong d.d H2SO4
-->Dễ suy ra kim loại B là Cu
(*)Giả sử oxit kim loại A là AO
AO+H2SO4-->ASO4+H2O
1..........1..........1 mol
m d.d sau pư=A+16+980=A+996 g
C% ASO4=11,765%
\(\Rightarrow\frac{A+96}{A+996}=0,11765\)
\(\Rightarrow A=24\left(Mg\right)\)
(*) Giả sử là A2O3 làm tương tự -->loại
Nếu ko chia trường hợp thì gọi là A2Ox hoặc AxOy

Trong hỗn hợp khí, Gọi $n_{CO} = a(mol) ; n_{CO_2} = b(mol)$
Ta có :
$a + b = \dfrac{1,344}{22,4} = 0,06(mol)$
$28a + 44b = (a + b)9.4$
Suy ra a = b = 0,03
$CO + O_{oxit} \to CO_2$
$n_O = n_{CO_2} = 0,03(mol)$
$\Rightarrow n_{Fe} = \dfrac{1,6 - 0,03.16}{56} = 0,02(mol)$
$n_{Fe} : n_O = 0,02 : 0,03 = 2 : 3$
Vậy oxit là $Fe_2O_3$
Khí thu được gồm CO dư và CO2.
PT: \(Fe_xO_y+yCO\underrightarrow{t^o}xFe+yCO_2\)
Ta có: \(n_{CO\left(banđau\right)}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{CO\left(dư\right)}=a\left(mol\right)\\n_{CO_2}=b\left(mol\right)\end{matrix}\right.\)
⇒ a + b = 0,06 (1)
Mà: Tỉ khối hhk so với He bằng 9
⇒ 28a + 44b = 9.4.0,06 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,03\left(mol\right)\\b=0,03\left(mol\right)\end{matrix}\right.\)
⇒ nCO (pư) = 0,03 (mol)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{y}n_{CO}=\dfrac{0,03}{y}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{1,6}{\dfrac{0,03}{y}}=\dfrac{160}{3}y\left(g/mol\right)\)
\(\Rightarrow56x+16y=\dfrac{160}{3}y\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: Oxit đó là Fe2O3.
Bạn tham khảo nhé!

t nghĩ khác :vv
\(O_{oxit}+O_{CO}=O_{CO_2}+O_{H_2O}\)
T chỉ làm thế này thôi :)