Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
![]()
Cho từ từ đến X vào 0,02 ml HCl thu được 0,015 mol khí CO2
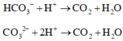
Giải được số mol HCO3- và CO32- phản ứng là 0,1 và 0,05 mol.
Do vậy trong X HCO3- và CO32- có tỉ lệ số mol là 2:1.
Vì còn CO32- nên kết tủa thu được là BaCO3 0,02 mol.
X chứa NaHCO3 và Na2CO3 với số mol lần lượt là 0,02 và 0,01 mol.
![]()

Đáp án D
nK2CO3 = nCO3 2- = 0,15.0,1 = 0,015 mol ; nNaHCO3 = nHCO3- = 0,15.0,2 = 0,03 mol
Do ban đầu H+ rất dư so với muối nên 2 muối đều phản ứng đồng thời
CO32- + 2H+ → CO2 + H2O
HCO3- + H+ → CO2 + H2O
=> nCO3 pứ: nHCO3 pứ = 0,015: 0,03 = 1: 2 = x: 2x
nHCl = 0,2.0,2 = 0,04 mol = 2.x + 1.2x = 4x => x = 0,01 mol
=> nCO2 = x + 2x = 3x = 0,03 mol
=> VCO2 = 0,03.22,4 = 0,672 lít = 672 ml

Chọn đáp án C
Tổng nH+ = 0,02 + 0,06 = 0,08 mà có n H C O 3 - = 0,03 và n H C O 3 2 - = 0,06 Þ Tỉ lệ 1: 2
Đặt số mol n H C O 3 - phản ứng = x Þ n H C O 3 2 - phản ứng = 2x Þ x + 2.2x = 0,08
Þ x = 0,08/5 = 0,016
Þ nCO2 = x + 2x = 3x0,016 = 0,048 Þ V = 0,048x22,4 = 1,0752
X lúc này có n S O 4 2 - = 0,06, n B a 2 + = 0,03 - 0,016 = 0,014; n C O 3 2 - = 0,06 - 0,032 = 0,028
Thêm vào X hỗn hợp 0,06 OH- và 0,15 Ba2+ Þ nOH- > n H C O 3 -
Þ Sau phản ứng với OH-, tổng n B a 2 + = 0,014 + 0,028 = 0,042
Vì 0,042 + 0,06 <0,15 Þ Ba2+ dư Þ nBaCO3 = 0,042 và nBaSO4 = 0,06
Vậy m = 0,042x197 + 0,06x233 = 22,254

Đáp án : C
0 , 03 m o l N a H C O 3 0 , 06 m o l K 2 C O 3 nhỏ từ từ 0 , 02 m o l H C l 0 , 06 m o l K H S O 4
=> 2 muối kiềm sẽ phản ứng theo tỉ lệ mol 1:2
Đặt số mol NaHCO3 phản ứng là x => số mol KCO3 phản ứng là 2x
=> nH+ = 0,02 + 0,06 = x + 2.2x => x = 0,016 mol
=> Sau phản ứng có : 0,014 mol HCO3- ; 0,028 mol CO32- và 0,06 mo SO42-
Khi cho X vào dung dịch chứa : 0,06 mol KOH và 0,15 mol BaCl2
=> nCO3 = 0,014 + 0,028 = 0,042 mol ; nSO4 = 0,06 mol
=> m kết tủa = mBaCO3 + mBaSO4 = 22,254g
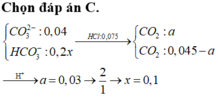
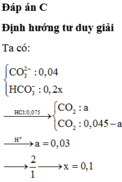
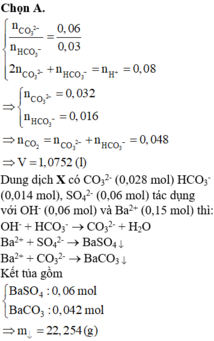
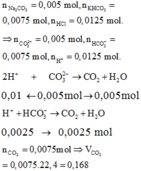

Đáp án C