Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thể tích khí đã tác dụng với dung dịch brom là : 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là :
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C 2 H 4
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH 4
% V C 2 H 4 = 4,48/6,72 x 100% = 66,67%; V CH 4 = 33,33%

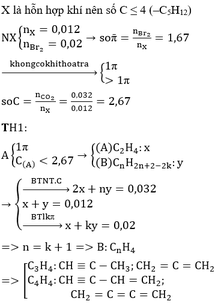
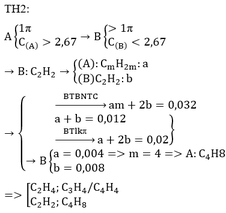
a) Mấu chốt ở chỗ chỉ số H bằng nhau
Đặt ankan M: CnH2n+2
→anken N: Cn+1H2n+2 (giải thích: anken có C = ½ H)
ankin P: Cn+2H2n+2 [giải thích: ankin có C = ½ (H + 2)]
·Xét TN đốt cháy hỗn hợp X:
nX = 0,4 mol; nCO2 = nCaCO3 = 0,7 mol
=> C trung bình =0,7: 0,4 = 1,75
=> Trong hỗn hợp có ít nhất một chất có số C < 1,75
=> n = 1
→M: CH4
N: C2H4 → CTCT: CH2=CH2
P: C3H4 → CTCT: CH≡C–CH3
b) Đặt CTTB: C1,75H4 (M=25)
=> số liên kết pi TB = 0,75
nX = 15 : 25 = 0,6mol
C1,75H4 + 0,75Br2 → C1,75H4Br1,5
0,6 → 0,45 (mol)
=> V = 450ml

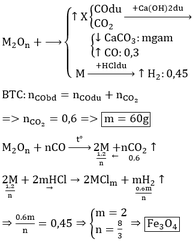
Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.

\(n_{CO_2}=\dfrac{8,96}{22,4}=0,4mol\)
\(m_{tăng}=m_{Br_2}=m_{C_2H_2}=2,6g\)
\(\Rightarrow n_{C_2H_2}=\dfrac{2,6}{26}=0,1mol\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
0,1 0,1
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_2+\dfrac{5}{2}O_2\underrightarrow{t^o}2CO_2+H_2O\)
0,1 0,25 0,2
\(\Rightarrow n_{CO_2\left(CH_4\right)}=0,4-0,2=0,2mol\)
\(\Rightarrow n_{CH_4}=0,2mol\Rightarrow n_{O_2}=0,4mol\)
a)\(\%V_{CH_4}=\dfrac{0,2}{0,4}\cdot100\%=50\%\)
\(\%V_{C_2H_2}=100\%-50\%=50\%\)
b)\(\Sigma n_{O_2}=0,4+0,25=0,65mol\)
\(\Rightarrow V_{O_2}=0,65\cdot22,4=14,56l\)
\(\Rightarrow V_{kk}=14,56\cdot5=72,8l\)

Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH 4 và C n H 2 n + 2
Theo đề bài V C 2 H 2 tham gia phản ứng là : 0,896 - 0,448 = 0,448 (lít).
Vậy số mol C 2 H 2 là 0,448/22,4 = 0,02 mol
Gọi số mol của CH 4 là X. Theo bài => số mol của C n H 2 n + 2 cũng là x.
Vậy ta có : x + x = 0,448/22,4 = 0,02 => x = 0,01
Phương trình hoá học của phản ứng đốt cháy hỗn hợp :
2 C 2 H 2 + 5 O 2 → 4 CO 2 + 2 H 2 O
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
2 C n H 2 n + 2 + (3n+1) O 2 → 2n CO 2 + 2(n+1) H 2 O
Vậy ta có : n CO 2 = 0,04 + 0,01 + 0,01n = 3,08/44 => n = 2
Công thức phân tử của hiđrocacbon X là C 2 H 6

ta có: nCO2 = nCaCO3 = 0,15 mol => nH2O = 0,4 molsau phản ứng với H2 thì Anken trở thành Ankan. Gọi CT chung của 2 Ankan là CaH(2a+2)CaH(2a+2) + (3a+1)/2 O2 ---> aCO2 + (a+1)H2O=> nCaH(2a+2) = nH2O - nCO2 = 0,4 - 0,15 = 0,25 mol (vô lí vì a >= 1 mà nCaH(2a+2) > nCO2)

\(n_{hhk}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
`->` Khí thoát ra là CH4
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,2 0,2 ( mol )
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,2 0,2 ( mol )
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
\(\%V_{CH_4}=\dfrac{0,2}{0,3}.100=66,67\%\)
\(\%V_{C_2H_4}=100-66,67=33,33\%\)
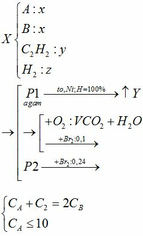
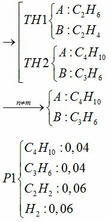
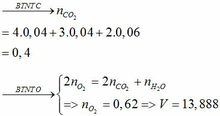
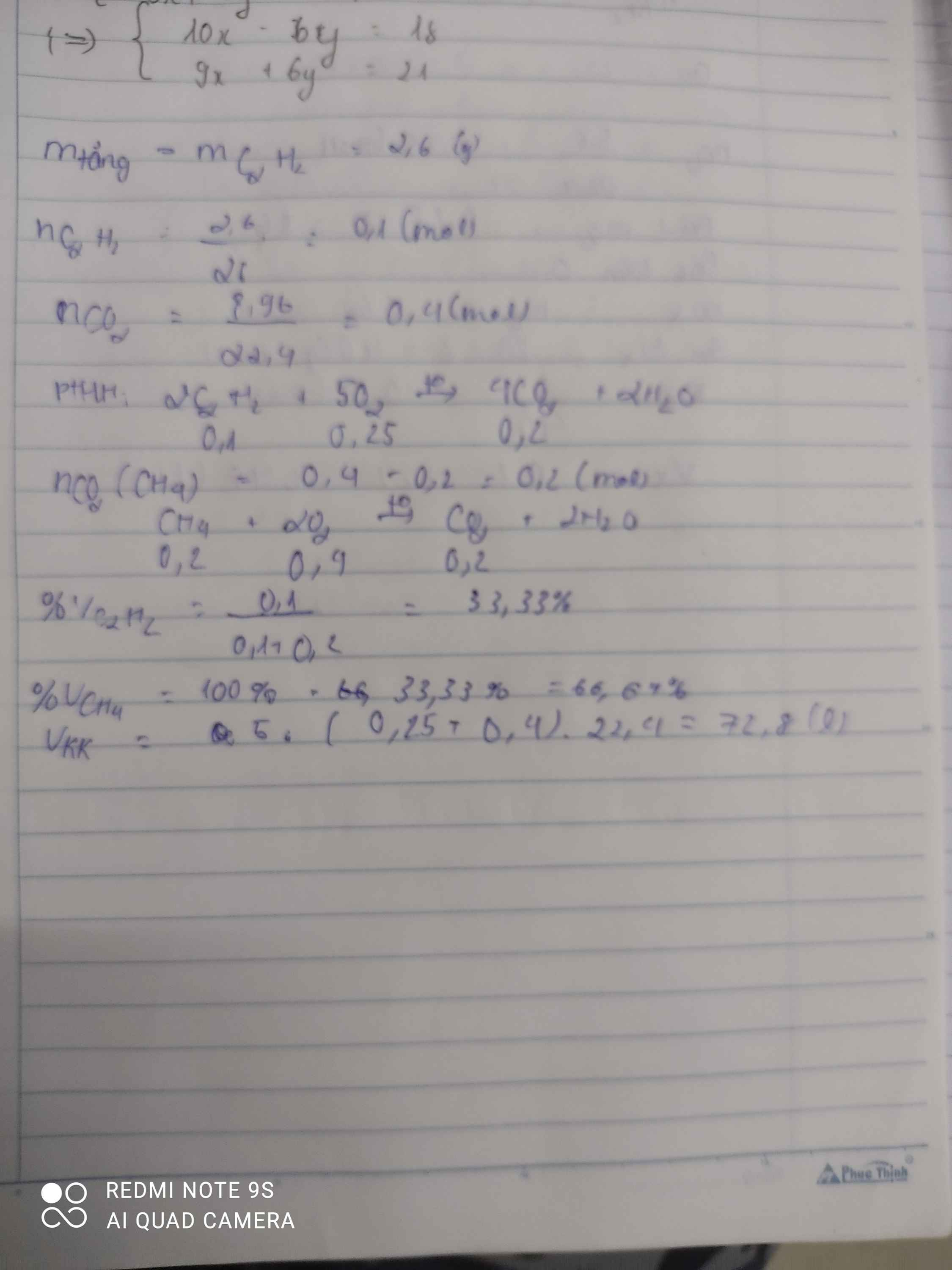
\(n_{CO_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_Y=n_{ankan}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(\text{Số nguyên tử C trong ankan : }\) \(\dfrac{0.6}{0.3}=2\)
\(CT:C_2H_6\)
\(n_{anken}=\dfrac{10.08-6.72}{22.4}=0.15\left(mol\right)\)
\(M_{anken}=\dfrac{6.3}{0.15}=42\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow14n=42\)
\(\Leftrightarrow n=3\)
\(CT:C_3H_6\)
Cho hỏi là 14n ở đâu ra vậy ạ