Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những cặp chất xảy ra phản ứng oxi hoá - khử :
(1)
(2) MnO2 + 4HCl > MnCl2 + Cl2 + 2H2O
b) Trong phản ứng (1) :
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hoá nguyên tử hiđro.
- Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2) :
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl được gọi là sự oxi hoá ion clo.
- Ion Mn nhận electron là chất oxi hoá. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.

Những phản ứng sau là phản ứng oxi hóa khử:
.jpg)
.png)
Cl2 vừa là chất khử vừa là chất oxi hóa.
b) .png) + 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
+ 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
CaOCl2: phân tử tự oxi hóa khử, HCl đóng vai trò môi trường
.jpg)
.png) Cl2 vừa là chất oxi hóa, vừa là chất khử.
Cl2 vừa là chất oxi hóa, vừa là chất khử.
.jpg)
.png)
HCl là chất khử, KClO3 là chất oxi hóa
.jpg)

CaOCl2: phân tử tự oxi hóa

Phương trình hóa học của phản ứng:
Cl2 + 2NaI → 2NaCl + I2
71g (2 x 127)g
X g 12,7g
X = 3,55g
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
(4 x 36,5g) 71g
Y g 3,55 g
Y = 7,3g
Khối lượng HCl cần dùng là 7,3g

Lưu huỳnh đioxit có thể tham gia các phản ứng sau :
SO2 + Br2 + 2H2O -> 2HBr + H2SO4 (1)
SO2 + 2H2O -> 3S + 2H2O (2)
Câu nào diễn tả không đúng tính chất hóa học của các chất trong những phản ứng trên ?
A.Phản ứng (1) : SO2 là chất khử, Br2 là chất oxi hóa.
B. Phản ứng (2) : SO2 là chất oxi hóa, H2S là chất khử.
C. Phản ứng (3) : SO2 vừa là chất khử, vừa là chất oxi hóa.
D. Phản ứng (1) : Br2 là chất oxi hóa, phản ứng (2) : H2S là chất khử.

4Mg +5H2SO4 đặc nóng =>4MgSO4 + H2S +4H2O
Tổng hệ số nguyên tối giản của các chất trong pt là 4+5+4+1+4=16
Tâm ơi , bn cộng nhầm rùi , là 18 chứ ko phải 16 .
cảm ơn bn đã trả lời câu hỏi giúp mình nhé .
![]()
![]()

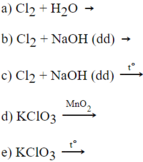
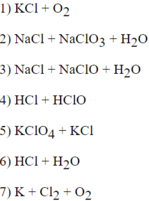
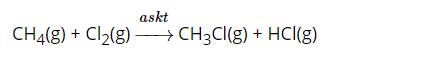

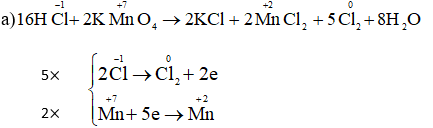
a) -4 b) -1 c) -5 d) -6