Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

phương trình phản ứng
FeO + H2 = Fe + H2O (1)
y y mol
Fe2O3 + 3H2 = 2Fe + 3H2O (2)
z 2z mol
Fe + CuSO4(dung dịch pha loãng) = FeSO4 + Cu↓ (3)
x x mol
theo phương trình phản ứng (3) áp dụng định luật thay đổi khối lhuowngj ta có 64x - 56x = 4,96 - 4,72 => x=0,03 mol
khối lượng của Fe là mFe = 0,03.56=1,68(g)
khối lượng của oxit sắt còn lại là 3,04 g
theo bài ra ta có phương trình
72y + 160z = 3,04
56y + 56.2z = 3,92 - 1,68
giải hệ phương trình ta có y= 0,02 z= 0,01
còn lại khối lượng bạn tự tính nha![]()

TN1 Fe ---> Fe
x x mol
FeO+ H2 ---> Fe + H2O
y y
Fe2O3 + 3H2---> 2Fe + 3H2O
z 2z
=> 56x + 72y+ 160z=2,36
TN2 Fe + CuSO4---> FeSO4+ Cu
x x mol
FeO và Fe2O3 không tác dụng
=> 64x+ 72y+ 16O z=2,48
lại có 56x+ 72y+ 160z=2,36
giả hệ 3 pt => x=0,015 ,y= 0,01 , z=0,005
=> mFe=0,84 gan , mFeO=0,72 gam, mFe2O3=0,8 gam.

\(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
y y
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
z 2z
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
x x
gọi x, y, z là số mol của Fe bđ, FeO bđ, \(Fe_2O_3bđ\)
có: \(\left\{{}\begin{matrix}56x+56y+\left(56.2\right)z=2,94\\56x+72y+160z=3,54\\64x+72y+160z=3,72\end{matrix}\right.\)
Giải được:
x = 0,0225
y = 0,015
z = 0,0075
=> m Fe bđ = 0,0225 . 56 = 1,26 (g)
m FeO bđ = 0,015.72 = 1,08 (g)
m \(Fe_2O_3\) bđ = 0,0075 . 160 = 1,2 (g)
( Với hệ pt:
- ở dòng 1, 56x, 56y, 112z là của pt Fe không td vs H2, pt FeO bị H2 khử và pt \(Fe_2O_3\) bị \(H_2\) khử.
- ở dòng 2, 56x: m Fe bđ
72y: m FeO bđ
160z: m \(Fe_2O_3\) bđ
- ở dòng 3, 64x: \(m_{Cu}\) khi Fe td với \(dd.CuSO_4\) tạo được x mol Cu
72y: m FeO không td với dd CuSO4
160z: m \(Fe_2O_3\) không td với dd \(CuSO_4\) )

A, Gọi X,y lần lượt là số mol của Mg và Al
Pthh:
Mg + H2SO4---> MgSO4 + H2
X. X. X. X
2Al + 3H2SO4---> Al2(SO4)3+3H2
Y. 1.5y. Y. 1.5y
Ta có pt:
24x + 27y= 1.95
X+1.5y=2.24/22.4=0.1
=> X=0.025, Y=0.05
%Mg= 0.025×24×100)/1.95=30.8%
%Al= 100%-30.8%=69.2%
mH2SO4= 0.025+1.5×0.05=0.1g
mH2= (0.025+0.05)×2=0.15g
C, Mdd H2SO4 = 0.1/6.5×100=1.54g
MddY= 1.54+1.95-0.15=3.34g
%MgSO4 vs %Al2(SO4)3 b tự tính nha

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
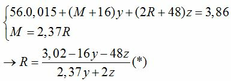
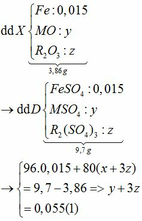
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%
