Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
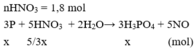
Nếu HNO3 hết → nNaOH cần dùng = 3,24 ≠ 3 (vô lí)
Vậy HNO3 dư; P hết
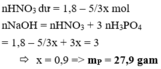

Dễ dàng thấy chất tan là CuSO4 = 0,02 mol (bảo toàn nguyên tố Cu)
=> Quy đổi ban đầu có 0,02 mol S (bảo toàn nguyên tố S) và 0,02 mol Cu
Bảo toàn e => n NO2 = 0,02.6 + 0,02.2 = 0,16 mol
QT cho e :
Cu → Cu2++ 2e
0,02 0,04 mol
S0 → SO42-+ 6e
0,02 0,12 mol
Số mol e cho là ne cho= 0,16 mol
Theo bảo toàn e : ne cho= ne nhận= 0,16 mol
QT nhận e :
N+5+ 1e → NO2
0,16 → 0,16 mol
2NaOH + 2NO2 => NaNO2 + NaNO3 + H2O
Do 0,2> 0,16 nên NO2 hết và NaOH dư
Vì NO2 hết nên n H2O = 0,08 mol (= ½ n NO2)
=> m chất rắn = mNO2+ mNaOH- mH2O= 40.0,2 + 0,16.46 – 0,08.18 = 13,92 gam
Đáp án C

Ta có nAl= 0,18 mol= nAl(NO3)3, nNaOH= 0,75 mol
Dung dịch X chứa Al(NO3)3, có thể có NH4NO3
Al3++ 3OH-→ Al(OH)3↓ (1)
0,18 0,54 0,18
Al(OH)3+ OH- → AlO2-+ 2H2O (2)
0,18 0,18
Tổng mol OH- ở (1) và (2) là nOH-= 0,54+ 0,18= 0,72 mol < 0,75 mol
Nên có PT (3) với nOH- PT3= 0,75- 0,72= 0,03 mol
NH4++ OH- → NH3+ H2O (3)
0,03 0,03 mol
QT cho e:
Al → Al3++ 3e (1)
0,18 0,54
QT nhận e:
NO3-+ 8e+ 10H+ → NH4++ 3H2O (2)
0,24 ← 0, 03 mol
NO3-+ 3e+ 4H+ → NO+ 2H2O (3)
Theo ĐL bảo toàn e: ne cho= ne nhận nên 0,54=8.nNH4++ 3.nNO
Hay 0,54=8. 0,03+ 3.nNO suy ra nNO= 0,1 mol → V= 2,24 lít
Đáp án D

đáp án D
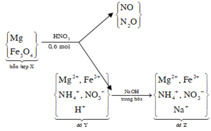
Ta có mKhí = mMg – mdd tăng = 0,56 gam
⇒ MKhí = 0,56 ÷ 0,02 = 28 ⇒ X là khí N2.
Bảo toàn e có nNH4NO3 = (2nMg – 10nN2) ÷ 8 = 0,0125
+ Nhận thấy cuối cùng Na sẽ đi về muối NaNO3 ⇒ Tìm ∑nNO3 có trong dung dịch Y.
Bảo toàn nito ta có nNO3/Y = nHNO3 – 2nN2 – nNH4 = 0,3475 mol.
⇒ nNaOH = 0,3475 mol ⇒ VNaOH = 0,17375 lít = 175,75 ml ⇒ Chọn D



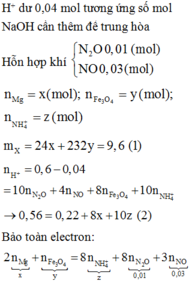
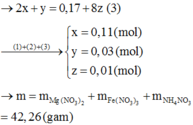
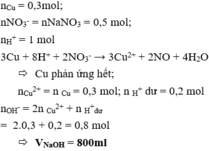
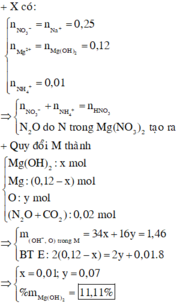
PTHH: \(3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\)
Ta có: \(n_{H_3PO_4}=\dfrac{1}{3}n_{NaOH}=\dfrac{3,33}{3}=1,11\left(mol\right)\)
Bảo toàn Photpho: \(n_P=n_{H_3PO_4}=1,11\left(mol\right)\) \(\Rightarrow m_P=1,11\cdot31=34,41\left(g\right)\)