Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Xét giai đoạn A tác dụng với H2SO4 đặc, nóng, dư:
Số mol SO2 thu được là: n SO 2 = 0 , 15 mol
Qui đổi hỗn hợp A thành Fe : a mol; O : b mol
![]()
Sơ đồ phản ứng :
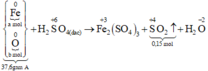
Các quá trình nhường, nhận electron:
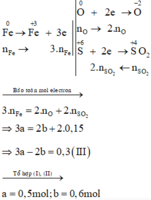
Xét giai đoạn để m gam Fe ngoài không khí:
Sơ đồ phản ứng :


Quy đổi X thành \(\left\{{}\begin{matrix}Fe:x\left(mol\right)\\O:y\left(mol\right)\end{matrix}\right.\)
`=> 56x + 16y = 6,72(2)`
\(M_Y=15.2=30\left(g/mol\right)\Rightarrow Y:NO\\ n_{NO}=\dfrac{0,4958}{24,79}=0,02\left(mol\right)\)
`BTe: 3x - 2y = 0,02.3 = 0,06(2)`
`(1),(2)=>x=0,09;y=0,105`
`=>` \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,045\left(mol\right)\)
`=> m = 0,045.160=7,2(g)`

Coi : B gồm : Fe ( x mol) , O ( y mol)
\(m_B=56x+16y=12\left(h\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
Bảo toàn e :
\(3x=2y+0.15\cdot2\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.18,y=0.12\)
\(m_{Fe}=0.18\cdot56=10.08\left(g\right)\)
Quy đổi hỗn hợp về Fe và O.
Giả sử: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_O=y\left(mol\right)\end{matrix}\right.\)
⇒ 56x + 16y = 12 (1)
Ta có: \(n_{SO_2}=0,15\left(mol\right)\)
Theo ĐLBT mol e, có: 3x - 2y = 0,15.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,18\left(mol\right)\\y=0,12\left(mol\right)\end{matrix}\right.\)
⇒ mFe = 0,18.56 = 10,08 (g)
Bạn tham khảo nhé!

Coi hh gồm Fe và O.
Ta có: 56nFe + 16nO = 14,64 (1)
Ta có: \(n_{NO}=\dfrac{1,4874}{24,79}=0,06\left(mol\right)\)
Theo ĐLBT e, có: 3nFe = 2nO + 3nNO ⇒ 3nFe - 2nO = 0,06.3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,201\left(mol\right)\\n_O=0,2115\left(mol\right)\end{matrix}\right.\)
⇒ m = mFe = 0,201.56 = 11,256 (g)

Đáp án C
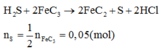
Chú ý: Không tồn tại muối sunfua của Al và Fe(III). H2S không phản ứng với AlCl3 nhưng nếu
![]()
Có sự khác nhau này do Fe3+ có tính oxi hóa mạnh còn Al3+ tính oxi hóa yếu
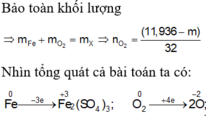
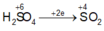
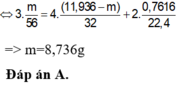




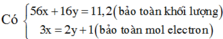
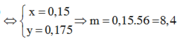


Áp dụng ĐLBTKL cho cả bài
Áp dụng ĐLBTKL cho nguyên tố N
Giải hệ rồi tính mFe