Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Gọi công thức của muối barihalogennua là BaR2 .
PTHH : \(BaR_2+H_2SO_4\rightarrow BaSO_4+2HR\)
- Gỉa sử số mol vừa đủ H2SO4 là 1 mol .
- Theo PTHH : \(n_{BaR_2}=n_{H_2SO_4}=n_{BaSO_4}=1\left(mol\right)\)
- Theo PTHH : \(n_{HR}=2n_{H_2SO_4}=2\left(mol\right)\)
\(m_{H_2SO_4}=n.M=1.98=98\left(g\right)\)
\(m_{ddH_2SO_4}=\frac{m_{H_2SO_4}.100\%}{C\%_{H_2SO_4}}=\frac{98.100\%}{5\%}=1960\left(g\right)\)
\(m_{BaR_2}=n.M=1.\left(137+2M_R\right)=137+2M_R\left(g\right)\)
\(m_{BaSO_4}=n.M=1.\left(137+32+16.4\right)=233\left(g\right)\)
- Ta có : \(m_{dd}=m_{H_2SO_4}+m_{BaR_2}-m_{BaSO_4}\)
=> \(m_{dd}=137+2M_R-233+1960=1864+2M_R\)
\(m_{HR}=n.M=2.M_{HR}=2.\left(M_R+1\right)\left(g\right)\)
Mà \(C\%_{HR}=\frac{m_{HR}}{m_{dd}}.100\%=3,77\%\)
=> \(\frac{2M_R+2}{1864-2M_R}=\frac{3,77}{100}\)
=> \(M_R\approx35,5\) ( đvc )
Vậy tên của halogen là clo .

nZn=0,3 mol; \(n_{H_2SO_4} = 0,4 mol\)
\(\begin{array}{l} Zn \to Z{n^{2 + }} + 2{\rm{e}}\\ 0,3\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,6\,mol \end{array} \)
Bảo toàn S: \({n_{\mathop S\limits^x }} = {n_{{H_2}S{O_4}}} - {n_{Zn{\rm{S}}{O_4}}} = 0,4 - 0,3 = 0,1\,mol\)
\(\begin{array}{l} \mathop S\limits^{ + 6} \, + \,(6 - x)e \to \mathop S\limits^x \\ 0,1\,\,\,\,\,\,\,\,\,0,6\,mol \end{array}\)
\(\rightarrow x=0\)
\(\rightarrow\) Sản phẩm khử là S.

\(a,PTHH:2Al+3X_2\rightarrow2AlX_3\\ Theo.ĐLBTKL,ta.có:\\ m_{Al}+m_{X_2}=m_{AlX_3}\\ \Leftrightarrow m_{Al}+33,6=37,38\\ \Leftrightarrow m_{Al}=3,78\left(g\right)\\ \Rightarrow n_{Al}=\dfrac{3,78}{27}=0,14\left(mol\right)\\ n_{X_2}=\dfrac{3}{2}.0,14=0,21\left(mol\right)\\ \Rightarrow M_{X_2}=\dfrac{33,6}{0,21}=160\left(\dfrac{g}{mol}\right)\\ \Rightarrow M_X=80\left(\dfrac{g}{mol}\right)\\ \Rightarrow X:Brom\left(Br=80\right)\\ b,n_{AlBr_3}=\dfrac{42,72}{267}=0,16\left(mol\right)\\ AlBr_3+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3AgBr\downarrow\left(vàng.nhạt\right)\\ n_{AgBr}=n_{AgNO_3}=0,16.3=0,48\left(mol\right)\\ \Rightarrow m_T=m_{\downarrow}=m_{AgBr}=188.0,48=90,24\left(g\right)\)
\(m_{ddZ}=42,72+447,52-90,24=400\left(g\right)\\ n_{Al\left(NO_3\right)_3}=n_{AlBr_3}=0,16\left(mol\right)\\ \Rightarrow C\%_{ddZ}=C\%_{ddAl\left(NO_3\right)_3}=\dfrac{0,16.213}{400}.100=8,52\%\)
\(c,n_{Br_2}=\dfrac{12,8}{160}=0,08\left(mol\right)\\ 2NaI+Br_2\rightarrow2NaBr+I_2\\ n_{I_2}=n_{Br_2}=0,08\left(mol\right);n_{NaI}=2.0,08=0,16\left(mol\right)\\ \Rightarrow x=C_{MddNaI}=\dfrac{0,16}{0,25}=0,64\left(M\right)\\ m_{I_2}=0,08.254=20,32\left(g\right)\)

Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
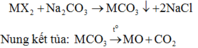
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
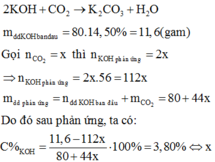 = 0,75
= 0,75

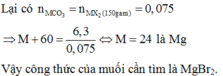



Tham khảo: