Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)

\(PT:Fe+Cu3O_4\rightarrow FeSO_4+Cu\)
\(m\uparrow=-mFe+mCu=4\left(g\right)\)
\(nFe=\dfrac{4}{-56+64}=0,5\left(mol\right)\)
\(\Rightarrow mFe=28\left(g\right)\Rightarrow mCu=72\)

Hai muối ban đầu có thể là K2CO3 và KHSO4
PTHH: K2CO3 + 2KHSO4 --> 2K2SO4 + CO2 + H2O
Do dd chỉ chứa K2SO4
=> Pư vừa đủ
\(\dfrac{n_{K_2CO_3}}{n_{KHSO_4}}=\dfrac{1}{2}\)
Xét \(\dfrac{m_{K_2CO_3}}{m_{KHSO_4}}=\dfrac{138.n_{K_2CO_3}}{136.n_{KHSO_4}}=\dfrac{69}{136}\)

Vì còn Cu nên chứng tỏ Fe+3 đã bị chuyển hết thành Fe+2 rồi.
gọi x là số mol Cu+2 và 2x là số mol Fe+2
Ta dùng phương pháp tăng giảm KL
64x + 56.2x - 24.3x = m tăng
m tăng = 4 + 0,05.24 ( một phần bị axit hòa tan ) suy ra x = 0,05
Vậy khối lượng Cu ban đầu là
1 + 0,05 .64 = 4,2 g
Số Mol axit bằng
3x.2 + 2.nH2 = 0,4 mol

PTHH: Fe + 2HCl → FeCl2 + H2 ↑
2Al + 6HCl → 2AlCl3 + 3H2 ↑
Gọi số mol của Fe là a, số mol của Al là 2b => Số mol của H2 ở pt (1) là a , số mol H2 ở pt (2) là 3b
Số mol của khí H2 sinh ra là: 11,2 : 22,4 = 0,5 mol
a) Ta có hệ phương trình:
- 56a + 54b = 16,6
- a + 3b = 0,5
=> a = 0,2 , b = 0,1
Khối lượng của sắt là: 56a = 56. 0,2 = 11,2 (gam)
%Fe là: (11,2 : 16,6).100% = 67,47%
Khối lượng của nhôm là: 54b = 54. 0,1 = 5,4 (gam)
%Al là: (5,4 : 16,6).100% = 32,53%
b) Khối lượng của HCl là: 2a+6b = 1 (mol)
Khối lượng của HCl là: 1 . 36,5 = 36,5 (gam)
Khối lượng dung dịch HCl là: 36,5 : 14,6% = 250 (g)
c) Khối lượng FeCl2 là: 127 . 0,2 = 25,4 (gam)
Khối lượng AlCl3 là: 133,5 . 2 . 0,1 = 26,7 (gam)
Sau đó áp dụng định luật bảo toàn khối lượng:
Khối lượng dung dịch muối thu được là:
16,6 + 250 - ( 0,5 . 2) = 265,6(gam)
Nồng độ phần trăm FeCl2 trong dung dịch muối là:
(25,4 : 265,6) . 100% = 9,564%
Nồng độ phần trăm AlCl3 trong dung dịch muối là:
( 26,7 : 265,6 ) . 100% = 10,06%
gọi x,y là số mol của Fe và Al trong hỗn hợp
nH2=0,4mol
PTHH: 2Al+6HCl=>2AlCl3+3H2
y---------------------->1,5y
Fe+2HCl=> FeCl2+H2
x-------------------->x
ta có hệ :\(\begin{cases}56x+27y=16,6\\x+1,5y=0,5\end{cases}\)<=> x=0,2 và y=0,2
=> mFe=0,2.56=11,2g
=> %mFe=67,47%
=> %mAl=32,53%
m(HCl)=(0,2+0,2).36,5=14,6g
=> khối lượng dung dịch đã dùng là : 146g

2 A l + 3 C u S O 4 → A l 2 S O 4 3 + 3 C u
x…………3/2.x
F e + C u S O 4 → F e S O 4 + C u
y……..y
Al phản ứng hết với C u S O 4 sau đó Fe mới phản ứng với C u S O 4 . Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ n C u = n C u S O 4 = 0,2.1 = 0,2 mol
⇒ m F e dư = m Y - m C u = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
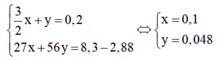
⇒ m A l = 0,1.27 = 2,7g
⇒ % m A l = 2,7/8,3.100 = 32,53%
⇒ Chọn A.
PT: \(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
_____x______\(\dfrac{3}{2}x\)___________________\(\dfrac{3}{2}x\) (mol)
Ta có: m thanh nhôm tăng = mCu - mAl
\(\Rightarrow11,5=\dfrac{3}{2}x.64-27x\Rightarrow x=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow n_{CuSO_4}=0,25\left(mol\right)\)
Mà: nMgSO4:nCuSO4 = 3:2 ⇒ nMgSO4 = 0,375 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MgSO_4}=\dfrac{0,375.120}{0,375.120+0,25.160}.100\%\approx52,94\%\\\%m_{CuSO_4}\approx47,06\%\end{matrix}\right.\)