Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Dùng không khó nén có nồng độ oxi cao và không khí đã nóng sẵn thổi vào lò cao nên tốc độ phản ứng tăng.
b) Lợi dụng yếu tố nhiệt độ (tăng nhiệt độ).
c) Lợi dụng yếu tố điện tích tiếp xúc (tăng điện tích tiếp xúc của nguyên liệu)
|
a) Lợi dụng yếu tố áp xuất và nhiệt độ ( tăng áp suất và nhiệt độ) b) Lợi dụng yếu tố nhiệt độ (tăng nhiệt độ) c) Lợi dụng yếu tố diện tích tiếp xúc bề mặt (tăng diện tích bề mặt tiếp xúc của nguyên liệu) |

nSO2 = 12,8 / 64 = 0,2 mol.
nNaOH = 1 x250 / 1000 = 0,25 mol.
a) Phương trình hóa học của phản ứng
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Gọi nNa2SO3 = x; nNaHSO3 = y.
nNaOH = 2y + x = 0,25.
nSO2 = x + y = 0,2.
Giải ra ta có: x = 0,15, y = 0,05.
mNaHSO3 = 0,15 x 104 = 15,6g.
mNa2SO3 = 0,5 x 126 = 63g.

A. Bất cứ phản ứng nào cũng phải đạt đến trạng thái cân bằng hóa học.
B. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì phản ứng dừng lại.
C. Chỉ có những phản ứng thuận nghịch mới có trạng thái cân bằng hóa học.
D. Ở trạng thái cân bằng, khối lượng các chất ở hai vế của phương trình phản ứng phải bằng nhau.

Điều chế MgCl2 bằng :
- Phản ứng hoá hợp : Mg + Cl2 —-> MgCl2
- Phản ứng thế : Mg + CuCl2 —-> MgCl2 + Cu
- Phản ứng trao đổi : Mg(OH)2 + 2HCl —-> MgCl2 + 2H2O
Điều chế MgCl\(_2\)bằng
- Phản ứng hóa hợp Mg + \(Cl_2\) —-> \(MgCl_2\)
-Phản ứng thế Mg + \(CuCl_2\) —-> \(MgCl_2\) + Cu
-Phản ứng trao đổỉ \(Mg\left(OH\right)_2\) + 2HCl —-> \(MgCl_2\) + 2\(H_2O\) .

Cho phản ứng : 2Na + Cl2 → 2NaCl
Trong phản ứng này, nguyên tử natri
A. bị oxi hoá.
B. bị khử.
C. vừa bị oxi hoá, vừa bị khử.
D. không bị oxi hoá, không bị khử.
2Na + Cl2 → 2NaCl
Trong phản ứng này, nguyên tử natri
A. bị oxi hoá.
B. bị khử.
C. vừa bị oxi hoá, vừa bị khử.
D. không bị oxi hoá, không bị khử.
vì Na0 đã nhường 1 electron để thành Na-1

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Xác định công thức phân tử của hợp chất A
nSO2 = 1,344 / 22,4 = 0,06 mol → mS = 0,06 x 32 = 1,92g
nH2O = 1,08 / 18 = 0,06 mol → mH = 0,06 x 2 = 0,12g.
Như vậy hợp chất A chỉ có nguyên tố S và H.
Đặt công thức phân tử hợp chất là HxSy.
Ta có tỉ lệ: x : y = 0,06 : 0,12 = 1: 2.
Vậy công thức phân tử của A và là H2S.
Phương trình hóa học của phản ứng:
nH2S = 2,04 / 34 = 0,06 mol.
3H2S + H2O → 4S + 4H2O.
nS = 4/3 nH2S = 0,08 mol.
mS = 0,08 × 32 = 2,56g.
Xác định công thức phân tử của hợp chất A
nSO2 = 1,344 / 22,4 = 0,06 mol → mS = 0,06 x 32 = 1,92g
nH2O = 1,08 / 18 = 0,06 mol → mH = 0,06 x 2 = 0,12g.
Như vậy hợp chất A chỉ có nguyên tố S và H.
Đặt công thức phân tử hợp chất là HxSy.
Ta có tỉ lệ: x : y = 0,06 : 0,12 = 1: 2.
Vậy công thức phân tử của A và là H2S.
Phương trình hóa học của phản ứng:
nH2S = 2,04 / 34 = 0,06 mol.
3H2S + H2O \(\rightarrow\) 4S + 4H2O.
nS = 4/3 nH2S = 0,08 mol.
mS = 0,08 × 32 = 2,56g.

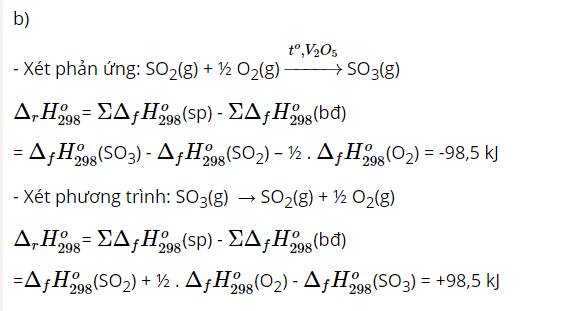
???????????????????????????????????????????????????