Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
Nhận thấy, nếu Z chỉ là H2 sẽ vô lý ngay vì không có sản phẩm khử nào thỏa mãn.
→ Khí thoát ra ở cả hai lần phải là hỗn hợp khí NH3 và H2.
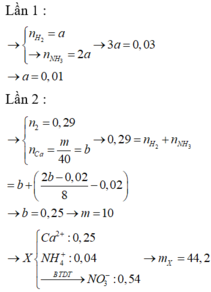
| GIẢI THÍCH THÊM + Lần đầu có hỗn hợp khí NH3 và H2 nên lần đầu NH4+ vẫn còn dư do đó với a mol H2 →2a mol OH →2a mol NH3. + Phương trình áp dụng ở lần 2 là BTE và 2 b - 0 , 02 8 là tổng số mol NH4+. |

Đáp án : A
nFe(OH)3 = 0,1 mol = nFe bđ => mO(X) = 4g
Qui X về 0,1 mol Fe và 0,25 mol O
Bảo toàn e : 3nFe = 2nO + 3nNO
=> nNO < 0 (Vô lý)
=> Fe3+ còn dư so với OH-
=> nOH- = nHNO3 dư + 3nFe(OH)3 => nHNO3 dư = 0,05 mol
=> nHNO3 pứ = 0,6 – 0,05 = 0,55 mol
Bảo toàn e : 3nFe = 2nO + 3nNO ; nHNO3 = 3nFe + nNO
Lại có : 56nFe + 16nO = 9,6g
=> nFe = 0,15 ; nO = 0,075 mol => nNO = 0,1 mol
=> V= 2,24 lit

Đáp án B
Định hướng tư duy giải
Nếu dung dịch Y chứa N H + 4 dư
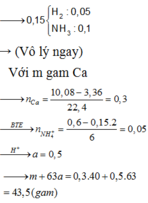

Đáp án : C
2 chất có số mol bằng nhau là FeCl2 và HCl
3Fe2+ + 4H+ + NO3- -> 3Fe3+ + NO + 2H2O
=> nH+ = 4nNO = 0,08 mol ( vì nFe2+ = nH+ => theo tỉ lệ mol phản ứng thì Fe2+ dư)
=> nFeCl2 = nHCl = 0,08 mol
Ag+ + Cl- -> AgCl
Fe2+ + Ag+ -> Fe3+ + Ag
=> Kết tủa gồm : 0,24 mol AgCl ; (0,08 – 0,06) mol Ag
=> a = 36,6g

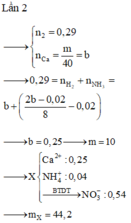


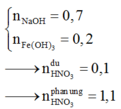
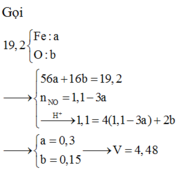
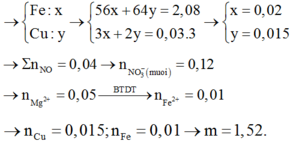

Đáp án : B
Khi thêm KOH vào X có khí thoát ra => sản phẩm khử N+5 là NH4NO3
=> Khí thoát ra đầu tiên là H2 và NH3 :
Na + H2O à NaOH + ½ H2
x à x à ½ x
NH4NO3 + NaOH à NaNO3 + NH3 + H2O
x à x
=> 0,015 mol = 1,5x è x = 0,01 mol
Và nNH4NO3 còn lại = nNH3 sau = 0,01 mol
Bảo toàn e : nNa = 2nH2 + 8nNH4NO3 = 0,17 mol
=> m = 3,91g