Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Nhiệt phân thấy mhh X giảm 1,44g ⇒ mH2O tách từ bazo = 1,44g.
⇒ Quy hỗn hợp X gồm: mX = mKim loại + mO + mH2O.
Phản ứng với HCl: Đặt nO/X = a ta có:
2a + 2nH2 = nHCl ⇔ nO/X = 0,58 mol.
⇒ mKim loại trong X = m – mO – mH2O = m – 10,72 gam.
●Phản ứng với HNO3 có thể sinh ra muối NH4NO3:
Đặt nNH4NO3 = b ta có:
mMuối = m + 108,48 = mKim loại + mNO3–/Muối kim loại + mNH4NO3.
⇔ m + 108,48 + (m – 10,72) + (2nO + 3nNO + 8nNH4NO3)×62 + 80b.
⇔ m + 108,48 + (m – 10,72) + (0,58×2 + 0,2×3 + 8b)×62 + 80b ⇔ b = 0,0175 mol.
⇒ ∑nHNO3 đã pứ = 10nNH4NO3 + 4nNO + 2nO = 2,135 mol

Đáp án B
m k l d d tan g = m ( g ) = m h h b a n d a u ⇒ không có sản phẩm khử khí.
![]()
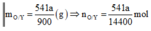
![]()
⇒ ∑ n N O 3 = 9 n N H 4 N O 3 = n O / 3
![]()
![]()
![]()
![]()
![]()
![]()
Tăng giảm khối lượng
![]()
⇒ a = 64 , 68 ( g )

Chọn B.
Nhận xét: Hòa tan hết m gam…,kết thúc thu được…tăng cũng m gam nên phản ứng giữa các kim loại với HNO3 chỉ thu được sản phẩm khử duy nhất là muối NH4NO3 (không có khí thoát ra)
Sơ đồ phản ứng:
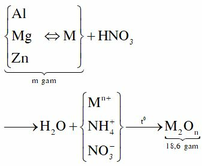
Ta có: Tổng số mol electron cho
của kim loại = tổng số mol điện tích
của các kim loại (M → Mn+ + ne)
Nên gọi số mol NH4NO3 là x mol thì

Vậy m = 12,84gam và a = 18,6 + 512x = 64,68gam

Đáp án A
Mg → Mg+2 +2e
Al→ Al+3 +3e
Zn → Zn+2 + 2e
N+5 + 8e → N-3
Muối có Mg(NO3)2, Al(NO3)3, Zn(NO3)2 và NH4NO3 → rắn nung nóng có MgO, ZnO, Al2O3
Đặt khối lượng kim loại trong 19,2 g rắn trên là x g và số mol O là y mol → x + 16y =19,2 mol
Trong muối nitrat của kim loại trong X có nNO3= 2y
Bảo toàn e có nNH4NO3 = y . 2 : 8 = 0,25y
Trong muối khan của dung dịch X có %O = ![]()
Nên x = 12,8 và y =0,4
→ m = x + 62.2y + 80.0,25y =70,4

Đáp án A
Mg → Mg+2 +2e
Al→ Al+3 +3e
Zn → Zn+2 + 2e
N+5 + 8e → N-3
Muối có Mg(NO3)2, Al(NO3)3, Zn(NO3)2 và NH4NO3 → rắn nung nóng có MgO, ZnO, Al2O3
Đặt khối lượng kim loại trong 19,2 g rắn trên là x g và số mol O là y mol → x + 16y =19,2 mol
Trong muối nitrat của kim loại trong X có nNO3= 2y
Bảo toàn e có nNH4NO3 = y . 2 : 8 = 0,25y
Trong muối khan của dung dịch X có %O =
![]()
Nên x = 12,8 và y =0,4
→ m = x + 62.2y + 80.0,25y =70,4

Đáp án A
Hướng dẫn giải :
Mg → Mg+2 +2e Al→ Al+3 +3e Zn → Zn+2 + 2e
N+5 + 8e → N-3
Muối có Mg(NO3)2, Al(NO3)3, Zn(NO3)2 và NH4NO3 → rắn nung nóng có MgO, ZnO, Al2O3
Đặt khối lượng kim loại trong 19,2 g rắn trên là x g và số mol O là y mol → x + 16y =19,2 mol
Trong muối nitrat của kim loại trong X có nNO3= 2y
Bảo toàn e có nNH4NO3 = y . 2 : 8 = 0,25y
Trong muối khan của dung dịch X có %O = ( 2 y + 0 , 25 y ) . 3 , 16 x + 62 . 2 y + 80 . 0 , 25 y . 100 % = 61 , 364 %
Nên x = 12,8 và y =0,4
→ m = x + 62.2y + 80.0,25y =70,4

Đáp án B
Mg, Al, Zn phản ứng với HNO3 không cho sản phẩm khử khí.
⇒ sản phẩm khử duy nhất là NH4NO3.!
⇒ Muối khan gồm Mg(NO3)2, Al(NO3)3, Zn(NO3)2 và NH4NO3.
nhiệt phân muối: R(NO3)n → R2On + NO2 + O2 ||⇒ là thay 2 gốc NO3 bằng 1O trong muối (☆)
Nhiệt phân muối amoni nitrat: NH4NO3 → N2O + 2H2O ||⇒ không thu được rắn.!
Đặt: nNH4NO3 = a mol ⇒ ngốc NO3 trong KL = ne cho = ne nhận = 8nNH4NO3 = 8a mol.
⇒ ∑nNO3 trong muối amoni + kim loại = a + 8a = 9a mol ⇒ ∑nO trong muối trong X = 27a mol
mà oxi chiếm 61,364% về khối lượng ⇒ m = 27a × 32 ÷ 0,61364 = 704a (gam).
lại có mNH4NO3 = 80a (gam) ⇒ mmuối nitrat kim loại = 624a (gam).
Ở (☆) dùng tăng giảm khối lượng ta có: 624a + (4a × 16 – 8a × 62) = 19,2 gam
giải ra a = 0,1 mol thay lại có m = 704a = 70,4 gam.
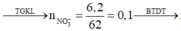
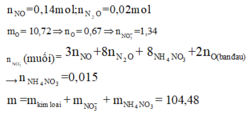
Đáp án D