Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Đặt \(\hept{\begin{cases}n_{Al}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{cases}}\)
PTHH : \(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Al+6HNO_3-->Al\left(NO_3\right)_3+3NO_2+3H_2O\) (2)
\(Cu+4HNO_3-->Cu\left(NO_3\right)_2+2NO_2+2H_2O\) (3)
Theo pthh (1) : \(n_{Al}=\frac{2}{3}n_{H_2}=0,2\left(mol\right)\) => \(x=0,2\left(mol\right)\)
Theo ptr (2); (3) : \(n_{NO_2}=3n_{Al}+2n_{Cu}\)
=> \(0,8=0,2\cdot3+2\cdot n_{Cu}\)
=> \(n_{Cu}=0,1\left(mol\right)\)
=> \(a=0,2\cdot27+0,1\cdot64=11,8\left(g\right)\)
b) PTHH : \(NH_3+HNO_3-->NH_4NO_3\) (4)
\(3NH_3+3H_2O+Al\left(NO_3\right)_3-->Al\left(OH\right)_3\downarrow+3NH_4NO_3\) (5)
\(2NH_3+2H_2O+Cu\left(NO_3\right)_2-->Cu\left(OH\right)_2\downarrow+2NH_4NO_3\) (6)
BT Al : \(n_{Al\left(OH\right)_3}=n_{Al}=0,2\left(mol\right)\)
BT Cu : \(n_{Cu\left(OH\right)_2}=n_{Cu}=0,1\left(mol\right)\)
=> \(m\downarrow=m_{Al\left(OH\right)_3}+m_{Cu\left(OH\right)_2}=25,4\left(g\right)\)
c) Gọi tên KL là X .
PTHH : \(2Al\left(NO_3\right)_3-t^o->Al_2O_3+6NO_2+\frac{3}{2}O_2\) (7)
\(Cu\left(NO_3\right)_2-t^o->CuO+2NO_2+\frac{1}{2}O_2\) (8)
\(4NO_2+O_2+2H_2O-->4HNO_3\) (9)
\(3X+4nHNO_3-->3X\left(NO_3\right)_n+nNO+2nH_2O\) (10)
viết ptr rồi, nhưng mik có thắc mắc là cho khí B hấp thụ vô nước => tính đc số mol của hno3, rồi áp vô X là ra, nhưng đề lại cho số mol NO =((( hoặc có thể dùng số mol NO để tính nhưng như thế có hơi thừa ko ? tính ra theo 2 cách thì cx ra 2 kq khác nhau ? ai githich giùm mik, hay mik tính sai hoặc phân tích đề sai nhỉ ?? :D

Xem hỗn hợp ban đầu được tạo thành từ: Fe, Cu và O2
Fe -------> Fe3+ + 3e
x.........................3x
Cu -------> Cu2+ + 2e
y..........................2y
O2 + 4e -----> 2O2-
z.........4z
S+6 + 2e -------> S+4
...........0,045..........0,0225
Gọi x, y, z là số mol Fe, Cu, O2. Ta có hệ gồm 3 pt:
56x + 64y + 32z = 2,44
3x + 2y = 4z + 0,045
0,5*400x + 160y = 6,6
=> x = 0,025, y = 0,01, z = 0,0125
=> %mCu = 0,01*64/2,44*100% = 26,23%

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Gọi a,b,c,d lần lượt là số mol của Al,Mg,Fe,Zn
Số mol H2 thu được n = = 0,065
Phương trình phản ứng khi cho hỗn hợp tác dụng với axit
Al Al3+ + 3e
a mol 3a mol
Mg Mg2+ + 2e
b mol 2b mol
Fe Fe2+ + 2e
c mol 2c mol
Zn Zn2+ + 2e
d mol 2d mol
2H+ +2e H2
2.0,065 0,065
ta có phương trình :
3a +2b + 2c + 2d =2.0,065 =0,13 (1)
Khi cho hỗn hợp trên tác dụng với clo thu được muối.như vậy khối lượng Clo có trong muối là : mCl2 = m+ 4,97 –m =4,97 gam
Suy ra nCl2 = 0,07 mol
Tuong tự như phương trình phản ứng trên ta có phương trình toán học
3a +3b + 2c + 2d =0,07.2 =0,14 (2)
Lấy (2) – (1) ta có : b=0,01 .suy ra khối lượng Fe = 0,01 . 56 = 0,56 g

Vì ta có thể tính được ngay số mol của N2 và H2 và đây cũng là dự kiện mấu chốt để tìm m với dạng toàn này nên đầu tiên ta tìm số mol của N2 và H2 bằng cách: đặt nN2 và H2 lần lượt là x, y. Ta được: x + y = 0,025
tỉ khối so với H2: 28x + 2y/ 2(x + y) = 11,4 (với x + y = 0,025)
=> x = 0,02; y = 0,005
Sử dụng bảo toàn electron: số mol electron nhường = số mol electron nhận thì: 2nMg > ***N2 + 2nH2 nên phản ứng có tạo NH4Cl
quá trình oxi hóa: Mg - 2e -----> Mg2+
quá trình khử: 2NO3- -10e ----> N2 (N(+5) -5e ----> N(0))
NO3- -8e ------> NH4+ (n(+5) - 8e ---> N(-3))
2H+ -2e ---> H2
Vậy 2.0,124 = 0,025.10 + 0,005.2 + 8nNH4+ => nNH4+ = 0,01
m = mMgCl2 + mNH4Cl = 0,145.95 + 0,01.53,5 = 14,31 gam
mol Mg = 0,145 ==> mol e nhường = 0,29 ==> mol NH4+ = 0,01
2 NO3- + 10e + 12 H+ ----> N2 + 6 H2O
0,04-------0,2------0,24-------0,02
NO3- + 8e + 10 H+ ----> NH4+ + 3 H2O
0,01----0,08------0,1-------0,01
2 H+ + 2e ----> H2
0,01----0,01------0,005
mol HCl = mol Cl- = mol H+ = 0,35
mol KNO3 = mol K+ = mol NO3- = 0,05
muối gồm : Mg2+ = 0,145 mol, NH4+ = 0,01 mol, K+ = 0,05 và mol Cl- = 0,35
khối lượng muối = 24*0,145 + 39*0,05 + 35,5*0,35 = 18,035

Đáp án D
Có
=>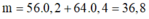
gam gần nhất với giá trị 36,82
=> Chọn đáp án D.