Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Các phản ứng đều là kim loại đẩy kim loại ra khỏi dung dịch muối → anion được bảo toàn.
Thứ tự các kim loại trong dãy điện hóa: Zn > Fe > Cu > Ag.
Theo đó, dung dịch cuối cùng chỉ chứa một muối duy nhất là 0,02 mol Zn(NO3)2.
ó Phản ứng: 5,2 gam Zn + ? gam Y → 0,02 mol Zn(NO3)2 + 5,82 gam chất rắn Z.
→
bảo toàn khối lượng ta có ![]()
ó Phản ứng: m gam (Cu, Fe) + 0,04 mol AgNO3 → 4,4 gam Y + 4,16 gam chất rắn X.
→ bảo toàn khối lượng ta có m = 4,4 + 4,16 – 0,04´170 = 1,76 gam.

Chọn đáp án A.
Các phản ứng đều là kim loại đẩy kim loại ra khỏi dung dịch muối => anion được bảo toàn.
Thứ tự các kim loại trong dãy điện hóa: Zn > Fe > Cu > Ag.
Theo đó, dung dịch cuối cùng chỉ chứa một muối duy nhất là 0,02 mol Zn(NO3)2
* Phản ứng: 5,2 gam Zn + ? gam Y " 0,02 mol Zn(NO3)2 + 5,82 gam chất rắn Z.
" bảo toàn khối lượng ta có mY = 0,02 × 189 + 5,82 - 5,2 = 4,4 gam.
* Phản ứng: m gam (Cu, Fe) + 0,04 mol AgNO3 " 4,4 gam Y + 4,16 gam chất rắn X.
" bảo toàn khối lượng ta có m = 4,4 + 4,16 - 0,04 × 170 = 1,76 gam.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 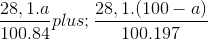 = 0,2
= 0,2
=> a = 29,89.

Chọn C
nZn = 0,06 mol ; nAgNO3 = nNO3 = 0,08 mol < 2nZn
=> Y chỉ chứa 0,04 mol Zn(NO3)2
Bảo toàn khối lượng : mZn + mmuối Y = mrắn + mmuối sau
=> mmuối Y = 6,14 + 0,04.189 – 3,9 = 9,8g
Bảo toàn khối lượng : m + mAgNO3 = mmuối Y + mX
=> m = 3,20g




Đáp án C
Ta có: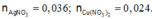
Ta có: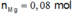
Bảo toàn điện tích:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: m = 4,826 - 0,038.24 + 4,21 - 0,036.108 - 0,024.64 = 2,7 gam