Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

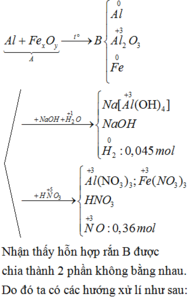
Phần O2 sinh ra khi nung đi hết vào kim loại tạo oxit, đó là lý do ta chỉ thu được một khí Z là NO2 (0,4 mol).
Khi nung hỗn hợp T trong không khí thì sản phẩm thu được sẽ gồm các oxit “bão hòa” hóa trị (CuO, Fe2O3).
Số mol electron tối đa mà X có thể cho là: 3nNO =0,54 mol
Như vậy sẽ cần 0,54/2 = 0,27 mol O đưa vào rắn X để thu được 41,6 gam rắn gồm các oxit “bão hòa”.
→mX = mr + mO = 41,6 -0,27.16=37,28 gam
→m =mX = mNO2 = 37,28+46x0,4=55,68 gam
Chọn đáp án A

- Viết đúng ptpư:
\(Fe+4HNO_3\rightarrow Fe\left(NO_3\right)_3+NO+2H_2O\)
\(3Cu+8HNO_3\rightarrow2Cu\left(NO_3\right)_2+2NO+4H_2O\)
\(nNO=0,04\left(mol\right)\)
Gọi nFe là x(mol) ; nCu là y(mol)
ta có hệ pt:
\(\left\{{}\begin{matrix}m_{hh}=56x+64y=3,04\\nNO=x+\dfrac{2}{3y}=0,04\end{matrix}\right.\)
Giải hệ ta được: x = 0,02 mol ; y = 0,03 mol
\(\Rightarrow mFe=0,02.56=1,12\left(g\right)\)
\(mCu=0,03.64=1,92\left(g\right)\)
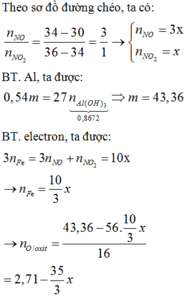
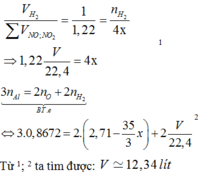


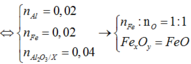
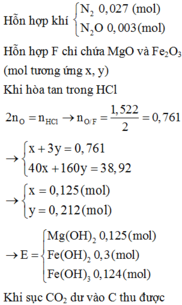


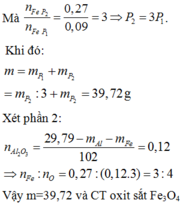

Al + 4HNO3 --> Al(NO3)3 + NO + 2H2O
Fe + 4HNO3 --> Fe(NO3)3 + NO + 2H2O
Dung dịch B gồm có Al(NO3)3, Fe(NO3)3 và HNO3. Chất kết tủa là Al(OH)3 và Fe(OH)3.
Đặt a, b là số mol của Al và Fe. Thiết lập hệ phương trình để tìm a và b.
nNO = a + b = 0.5 mol.
m kết tủa = 78a + 104 b = 41.9 gam
giải ra a = 0.4 , b = 0.1.
Suy ra khối lượng hỗn hợp kim loại m = 27*0.4 + 56*0.1 =16.4 gam
Tính %mAl = (0.4*27*100)/16.4 = 65.85%, %mFe = 43.15%
Chúc bạn học tốt nhé. Không hiểu thì inbox mình nhé :D
Chào bạn