Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
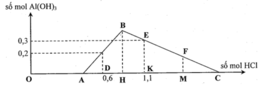
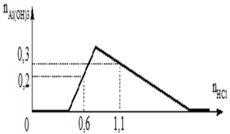
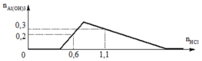
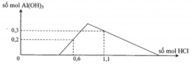
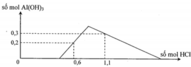
Đoạn OA biểu diễn tỉ lệ phản ứng: Ba(OH)2 + 2HCl → BaCl2 + 2H2O.
•Đoạn AB biểu diễn tỉ lệ phản ứng:
![]()
•Đoạn BC biểu diễn tỉ lệ phản ứng:
![]()
Từ tỉ lệ mà các đoạn trên đồ thị biểu diễn, gọi các điểm như trên, ta có ngay:
![]() (1)
(1)
mà
![]()
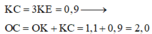 (2) .
(2) .
Mà lại từ tỉ lệ biểu diễn
:![]()
nên
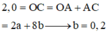
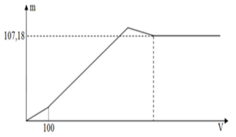
Xét phản ứng giữa dung dịch X chứa 0,2 mol Ba(OH)2 và 0,2 mol Ba(AlO2)2 với 0,7 mol H2SO4.
chỉ xét riêng H+ tương ứng là 1,4 mol, tức
![]()
Xét tương quan giữa số SO 4 2 - mol và số mol Ba 2 + thì có thêm 0,4 mol BaSO4↓ nữa.
Vậy, tổng kết tủa thu được cuối cùng là 0,4 mol BaSO4 và 0,2 mol Al(OH)3
![]()

Thêm từ từ 70 ml dung dịch H2SO4 1,25M vào 100ml dung dịch Na2CO3 1M
+ 2Na2CO3 + H2SO4 → 2NaHCO3 + Na2SO4
+ NaHCO3 + H2SO4 → Na2SO4 + CO2 + H2O
=> (Y) có nHCO3- = 0,025 mol và nSO42-= 0,0875 mol
. Cho Ba(OH)2 dư vào dung dịch Y
=> m kết tủa = mBaSO4 + mBaCO3= 25,3125g
=>D

Chọn đáp án C.
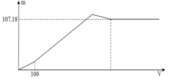
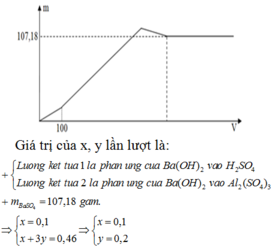
Vì cho thể tích X bao nhiêu thì tỉ lệ nBa(OH)2 : nNaOH = 1:2 nên ta cố định tỉ lệ này với các giai đoạn phản ứng, đặt nH2SO4 ban đầu = a và Al2(SO4)3 ban đầu = b ta có:
Đoạn 1 (chỉ có BaSO4 tạo thành):
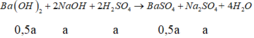
Đoạn 2 (có cả BaSO4 và Al(OH)3):
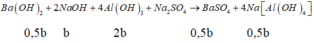
Đoạn 4 (chỉ có BaSO4 tạo thành
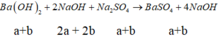
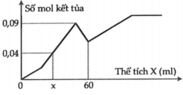
Tại vị trí số mol kết tủa là 0,09 chính là ngay khi kết thúc giai đoạn 2 → 0,5a + 3,5b = 0,09
Tại vị trí thể tích X là 60 ml chính là ngay khi kết thúc giai đoạn 3 → 0,5a + 1,5b + 0,5b = 0,06
Từ đó tính được a = 0,04 và b = 0,02
Tại vị trí thể tích X là x ml chính là giữa chừng của giai đoạn 2
nKết tủa = 0,04 → 0,5a + (x/1000 – 0,5a)×7/3 =0,04 thay a = 0,04 vào = x = 200/7 = 28,571.


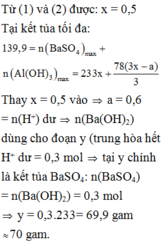
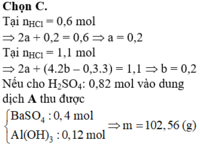
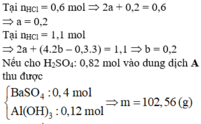



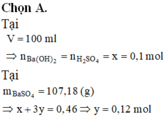
Chọn B.
Dung dịch Y có n A l 2 ( S O 4 ) 3 = V/3 = x m o l và n A l C l 3 = V 3 = x m o l .
⇒ n A l 3 + = 3 x m o l = n S O 4 2 -
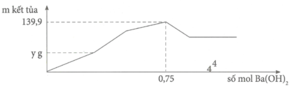
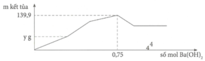
Tại n B a ( O H ) 2 = 0,75 mol => n O H - = 1,5 mol: lúc này cả 2 kết tủa tối đa với
n A l ( O H ) 3 = 1 / 3 n O H - = 0 , 5 m o l ⇒ n B a S O 4 m a x . 233 + 0 , 5 . 78 = 139 , 9 ⇒ n B a S O 4 m a x = 0 , 433 < 0 , 5 ⇒ v ô l ý
Chứng tỏ trong dung dịch Y còn H+ dư đoạn đồ thị đi lên đầu tiên đến y chỉ có 2 phản ứng là: H + + O H - → H 2 O ⇒ n O H - kết tủa hết Al3+ = 1,5 - a
⇒ n A l ( O H ) 3 m a x = 1 , 5 - a 3 ( 1 ) S O 4 2 - + B a 2 + → B a S O 4 (1)
Dung dịch Y ( : x mol, Cl-: x mol, H+: a mol)
Bảo toàn điện tích: n A l 3 + = 3 x - a 3 ⇒ n A l ( O H ) 3 m a x = 3 x - a 3 (2)
Từ (1) và (2), ta được: x = 0,5 mol
Tại kết tủa tối đa: 139 , 9 = n B a S O 4 m a x + n A l ( O H ) 3 m a x = 233 x + 78 ( 3 x - a ) 3
Thay x = 0,5 vào a = 0,6 mol = n(H+) dư n(Ba(OH)2) dùng cho đoạn y (trung hòa hết H+ dư = 0,3 mol tại y chính là kết tủa
BaSO4: n(BaSO4) = n(Ba(OH)2) = 0,3 mol
=>y = 0,3.233= 69,9 gam ≈ 70 gam.