Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
(a) Sai vì nguyên tố hidro không phải kim loại.
(b) Đúng vì tính dẫn điện của kim loại giảm dần theo thứ tự Ag > Cu > Au > Al > Fe.
(c) Sai trong dung dịch Cu2+ có H2 ⇒ Na sẽ tác dụng với H2O trước.
(d) Sai vì không thể tạo ra 2 điện cực khác nhau về bản chất.
(e) Đúng vì nếu AgNO3 dư thì chỉ tạo ra được 1 muối là Fe(NO3)3. Tuy nhiên có thêm AgNO3 dư
(g) Sai vì FeCl3 dư ⇒ Mg hết trước Fe3+ ⇒ không thu được Fe.

Đáp án C
(2) Sai, Cho Mg dư vào dung dịch FeCl3, kết thúc phản ứng thu được dung dịch chứa muối MgCl2.
(4) Sai, Cho AgNO3 tác dụng với dung dịch FeCl3, thu được kim loại AgCl và Fe(NO3)3.
(5) Sai, Điện phân dung dịch KCl với điện cực trơ, thu được khí H2 ở catot.
(6) Sai, Kim loại K không khử được ion Cu2+ trong dung dịch CuSO4.

Chọn A.
(a) Sai, Các nguyên tố ở nhóm IA (trừ H) đều là kim loại.
(c) Sai, Kim loại Na không khử được ion Cu2+ trong dung dịch thành Cu.
(d) Sai, Nhôm bị ăn mòn hoá học khi cho vào dung dịch chứa Na2SO4 và H2SO4.
(g) Sai, Cho Mg vào dung dịch FeCl3 (dư) sau phản ứng không thu được kim loại

Đáp án C
Ta có: n A l = 0,12 mol
Đem hòa tan các chất thu được bằng Ba(OH)2 dư không tạo thành khí H2 do vậy Al hết, sau phản ứng thu được Al2O3 0,06 mol, Fe và Fe3O4có thể dư.
→ m = 0,06.102+15,68-3,24 = 18,56 gam

TL:
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (1)
0,2 0,3 mol 0,1 mol 0,3 mol
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O (2)
0,2 mol 0,6 mol 0,2 mol
Số mol của Al = 2/3 lần số mol của H2 (0,3 mol) = 0,2 mol. Do đó, số mol của Al2O3 = (25,8 - 27.0,2)/102 = 0,2 mol.
a) Sau phản ứng, số mol của Al2(SO4)3 thu được là 0,3 mol, do đó khối lượng = 102,6 gam.
b) Số mol H2SO4 = 0,9 mol, do đó khối lượng dd = 98.0,9.100/19,6 = 450 gam.
c) Khối lượng dd sau phản ứng = 450 + 25,8 - 2.0,3 = 475,2 gam.
Do đó: C% (Al2(SO4)3) = 102,6/475,2 = 21,59%.

Chọn A
nH+ = 12nN2 + 10nNH4+ + 2nO (oxit) ⇒ nNH4+ = 0,05
Trong dung dịch Y có a mol Mg2+; b mol Fe3+; c mol Fe2+
⇒ nKOH = 2a + 3b + 2c + nNH4+ = 3,15 ⇒ 2a + 3b + 2c = 3,1 (1)
Sau khi tác dụng với KOH thì phần dung dịch chứa 3,15 mol K+; 1,54 mol SO42- và nNO3- = 0,07
Bảo toàn N ⇒ nNO3- ban đầu = 2nN2 + nNH4+ + nNO3- (trong Y) = 0,2
⇒ mX = 24a + 56(b + c) + 62.0,2 + 1,05.16 = 86 (2)
Bảo toàn ne ⇒ 3nAl phản ứng = 3nFe3+ + 2nFe2+ ⇒ nAl phản ứng = b + 2c/3
⇒ mtăng = 56(b + c) – 27(b + 2c/3) = 28 (3)
(1), (2), (3) ⇒ a = 0,15; b = 0,9; c = 0,05
Oxit thu được gồm MgO (0,15 mol) và Fe2O3 (0,95/2 = 0,475) ⇒ m = 0,15.40 + 0,475.160 = 82

Gọi nAl=x mol và nFe2O3 = y mol
Fe2O3 + 2Al → Al2O3 + 2Fe
Đầu(mol) y x
Do chất rắn sau +NaOH tạo khí nên dư Al
=> nH2=1,5nAl => 0,06= x-a mX= 160y + 27x = 21,67
m rắn không tan = mFe2O3 + mFe = 160(y – ½ a) + 56a=12,4
Giải hệ : x=0,21mol ; y=0,1mol ; a =0,15mol.
Tính hiệu suất theo Fe2O3 => %H= (0,075/0,1) .100%= 75%
=>D
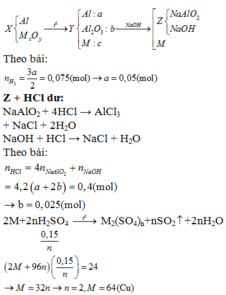
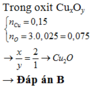

Mấy pạn giúp mìh zs..
nH2=\(\frac{3,36}{22,4}=0,15mol\)
Phương trình phản ứng: 2Al + 3H2SO4 ---------> Al2(SO4)3 + 3H2
0,1<---- -------------------------------------- 0,15
nAl= \(\frac{0,15.2}{3}=0,1mol\)
a) mAl= 27.0,1=2 ,7g
b) nAl= \(\frac{4,05}{27}=0,15mol\)
nH2SO4= \(\frac{29,4}{98}=0,3mol\)
Phương trình phản ứng: 2Al + 3H2SO4 ---------> Al2(SO4)3 + 3H2
0,15--->0,225
nH2SO4phản ứng=\(\frac{0,15.3}{2}=0,225mol\)
nH2SO4dư=0,3- 0,225 = 0,075mol
mH2SO4dư=98.0,075= 7,35g
c) Gọi M(II) là kim loại cần tìm
Phương trình phản ứng: M + H2SO4 ---------> MSO4 + H2
0,3 --------------> 0,3
nmuối=\(\frac{48,3}{M+96}=0,3\) (mol)
<=> \(0,3M+28,8=48,3\)
<=> M=65
Vậy kim loại cần tìm là kẽm (Zn)
<=> M=