Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`MO + 2HCl -> MCl_2 + H_2O`
Theo PT: `n_(MO) = (n_(HCl))/2`
`<=> 8/(M_M +16) = (0,4)/2`
`<=> M_M = 24`
`=>M` là `Mg`.
\(MO+2HCl\rightarrow MCl_2+H_2O\)
Ta có : \(n_{MO}=\dfrac{1}{2}n_{HCl}=0,2\left(mol\right)\)
=> \(M_{MO}=\dfrac{8}{0,2}=40\)
=> M=24 (Mg)

Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)

1 Gọi công thức oxit của kim loại hóa trị III là A2O3,ta có các phương trình sau
A2O3+3H2SO4--->A2(SO4)3+3H2O (1)
0,02 0,06 0,02
Vì sau phản ứng (1) dung dịch còn có thể phản ứng với CaCO3 giải phóng khí CO2=>axit H2SO4 dư,ta có phương trình
H2SO4+CaCO3--->CaSO4+CO2+H2O (2)
0,01 0,01 0,01 0,01
nCO2=0,224:22,4=0,01 mol
Khối lượng muối A2(SO4)3 sau khi cô cạn là
9,36-0,01x(40+96)=8 g
Ta thấy rằng A2O3=3,2 g,sau phản ứng tạo thành muối A2(SO4)3=8g Như vậy khối lượng tăng thêm là do 3 gốc -SO4 thay thế cho 3 nguyên tử Oxi,vậy khối lượng tăng thêm là 8-3,2 =4,8 g
nA2SO4=4,8:(96x3-16x3)=0,02 mol
=>khối lượng muối=0,02x(2xR+96x3)=8
=>R=56
R hóa trị III, có M=56=>R là Fe,công thức oxit là Fe2O3
nH2SO4=0,01+0,06=0,07 mol
mH2SO4=0,07x98=6,86g
C% dd H2SO4=(6,86:200)x100%=3,43%
2.
nH2O = 0.25 mol => nH2 = 0.25 mol
=> nH2/ B = 0.5 mol => nH+ = 1 mol = nHCl pứ = nCl- ( H+ + Cl- = HCl )
=> mCl- = 35.5g => m muối A = 35.5 + 18.4 = 53.9g
b/ m ( dd NaOH ) = 240g => m NaOH = 48g => n NaOH = 1.2 mol
H2 + Cl2 ---> 2HCl
0.5 1
NaOH + HCl --> NaCl + H2O
1 1 1 1
Khối lượng dd lúc này: 1*36.5 + 240 = 276.5 gam
mNaCl tạo thành = 58.5g => C% NaCl = 21.15%
%NaOH dư = ( 1.2 - 1 ) * 40 / 276.5 = 2.89%
c/ Gọi khối lượng mol của KL nhẹ hơn ( A ) là x => khối lượng mol của KL còn lại ( B ) là 2.4 * x
Vì số mol của 2 KL bằng nhau và bằng a mol
=> 3a + 2a = 5a = 1 mol => a = 0.2 mol ( KL hóa trị III td với 3 mol HCl, KL hóa trị II td 2 mol HCl )
=> 0.2*x + 0.2*2.4*x = 18.4 => x = 27.
A: Al
B: Zn
Anh giải đặt ẩn nhiều,trông hơi khó coi nên em trình bày cho đẹp nha!!

\(a/\\ M+2nHCl \to MCl_n+nH_2\\ n_{H_2}=\frac{5,6}{22,4}=0,25(mol)\\ n_M=\frac{1}{n}.n_{H_2}=\frac{1}{n}.0,25=\frac{0,25}{n}(mol)\\ M_M=\frac{16,25.n}{0,25}=65.n(g/mol)\\ \text{Chạy biện luân:}\\ \Rightarrow n=1; R=65(Zn)\\ b/\\ Zn+2HCl\to ZnCl_2+H_2\\ n_{HCl}=2.n_{H_2}=2.0,25=0,5(mol)\\ V_{HCl}=\frac{0,5}{0,2}=2,5M \)
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : M + 2HCl → MCl2 + H2\(|\)
1 2 1 1
0,25 0,25
a) Số mol của kim loại M
nM = \(\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
⇒ MM = \(\dfrac{m_M}{n_M}=\dfrac{16,25}{0,25}=65\) (dvc)
Vậy kim loại M là Zn
b) Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,25 0,5
Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
Thể tích của dung dịch axit clohdric cần dùng
CMHCl = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)
Chúc bạn học tốt

Khi cho A vào H2O và khi cho A vào NaOH thể tích khí thoát ra khác ở TN1 bé hơn chứng tỏ trong TN1 Al dư, vậy nH2 = 0,04 mol = 4nBa => nBa = 0,01 mol
Ba + H2O ------> Ba(OH)2 + H2
Al + OH- + H2O -----> AlO2- + 3/2 H2
nOH- = 2nBa
nH2 = nBa + 3/2.2nBa = 4nBa
nH2 ở TN2 = 0,31 mol = nBa + 3/2 nAl ( Vì OH- dư)
=> nAl = 0,2 mol
nH2 ở TN3 = 0,41 mol = nBa + 3/2nAl + nMg
=> nMg = 0,1 mol
Al + 3HCl -----> AlCl3 + 3/2H2
Mg + HCl -------> MgCl2 + H2
1. m = 21,5 gam
%Ba = 0,1.137/ 21,5.100 = 63,72%
%Al = 0,2.27/ 21,5.100 = 25,12%
%Mg = 100 -25,12 - 63,62 = 11,16%

\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(n_{Al}=\dfrac{0,81}{27}=0,03mol\)
\(B:8,12g\left\{{}\begin{matrix}Cu:a\left(mol\right)\\Ag:b\left(mol\right)\\Fe:c\left(mol\right)\end{matrix}\right.\Rightarrow64a+108b+56c=8,12\)(*)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,03 0,03
\(\Rightarrow c=n_{Fe}=0,03mol\)
Thay vào (*) ta được: \(64a+108b=8,12-0,03\cdot56\left(1\right)\)
\(n_{Fepư}=0,05-0,03=0,02mol\)
\(BTe:2n_{Cu}+n_{Ag}=3n_{Fepư}+2n_{H_2}\)
\(\Rightarrow2a+b=2\cdot0,02+3\cdot0,03\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,03\end{matrix}\right.\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,1}=0,5M\)
\(C_{M_{AgNO_3}}=\dfrac{0,03}{0,1}=0,3M\)
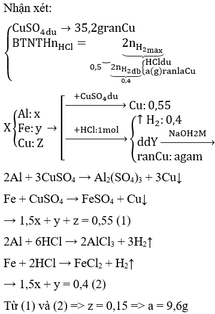
Cho kim loại M có hóa trị (III). Cho 10,2 gam oxit của M vào dung dịch axit clohiđric. Sau khi kết thúc phản ứng thấy có 0,6 mol HCl đã phản ứng. Kim loại M là
A. Fe
B. Mg
C. Cu
D. Al
\(M_2O_3+6HCl\rightarrow2MCl_3+3H_2O\)
\(n_{oxit}=\dfrac{1}{6}n_{HCl}=0,1\left(mol\right)\)
Ta có : \(M_{oxit}=2M+16.3=\dfrac{10,2}{0,1}=102\)
=> M=27 (Al)
Cho kim loại M có hóa trị (III). Cho 10,2 gam oxit của M vào dung dịch axit clohiđric. Sau khi kết thúc phản ứng thấy có 0,6 mol HCl đã phản ứng. Kim loại M là
A. Fe
B. Mg
C. Cu
D. Al