Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
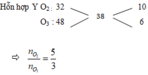
Giả sử số mol của Y = 0,8 mol => nX = 0,4mol
Bảo toàn nguyên tố O => 2nO2 + 3nO3 = 2nCO2 + nH2O = 1,9
nCO2 : nH2O = 6:7
=> nCO2 = 0,6 và nH2O = 0,7 mol
mX = mC + mH = 0,6 . 12 + 0,7 . 2 = 8,6g
=> MX = 8,6 : 0,4 = 21,5
dX/H2 = 10,75

Chọn đáp án C
Đốt 1 mol CxH2y + 10 mol O2 ―t0→ x mol CO2 + y mol H2O + ? mol O2 dư.
Bảo toàn nguyên tố O có nO2 dư = (10 – x – 0,5y) mol.
H2SO4 đặc hấp thụ H2O ⇒ hỗn hợp khí Z gồm CO2 và O2 dư.
dZ/H2 = 19 → MZ = 38 ⇒ nCO2 : nO2 dư = (38 – 32) ÷ (44 – 38) = 1 : 1
⇒ x = 10 – x – 0,5y ⇒ 4x + 2y = 20 ||⇒ x = 4; y = 8.
Vậy, công thức phân tử của X là C4H8. Chọn đáp án C.

Đáp án C
Hướng dẫn M Z - = 19.2 = 18 gam/mol Þ Z gồm CO2 và O2
Áp dụng sơ đồ đường chéo ta có
n C O 2 n C O 2 = 44 - 38 38 - 32 = 1 1
Phương trình phản ứng :
CxHy + (x + y 4 )O2 ® xCO2 + y 2 H2O
bđ: 1 10
pư: 1 ® (x + y 4 ) ® x
spư: 0 10 – (x + y 4 ) x
Þ 10 – (x + y 4 ) = x Þ 40 = 8x + y Þ x = 4 và y = 8

Chọn đáp án C
tính được nH2 = 0,15 mol; n C4H4 = 0,05 mol.
Khi nung nóng thì khối lượng hỗn hợp: msau pư = mtrước pư = 0,15 × 2 + 0,05 ÷ 52 = 2,9 gam.
từ tỉ khối hh sau pư với H2 → n hh sau pư = 2,9 ÷ 2 ÷ 14,5 = 0,1 mol.
Chú ý: nH2 pư = n hh trước pư – n số mol hh sau pư = 0,2 – 0,1 = 0,1 mol.
►Thêm nữa, H2 phản ứng sẽ cộng vào nối đôi, làm mất 0,1 mol liên kết π của hh trước pư.
Mà số mol lk π trước pư là: 0,05 × 3 = 0,15 nên sau phản ứng chỉ còn 0,15 – 0,1 = 0,05 mol π.
Vậy khối lượng brom đã phản ứng sé là: 0,05 × 160 = 8 gam.
Ta chọn đáp án C.

Đặt nA = 1 ⇒ nO2 = 10
số C(A) = n ⇒ nCO2 = n
Hỗn hợp Z gồm O2 và CO2
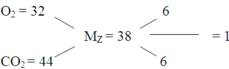
⇒ nO2 dư = nCO2 = n ⇒ nO2 phản ứng = 10 – n
Áp dụng định luật bảo toàn O có :
2nO2 phản ứng = 2nCO2 + nH2O
⇒ nH2O = 2(10 – n) – 2n = 20 – 4n
⇒ số H(A) = 40 – 8n
+ với n = 4 ⇒ số H(A) = 8 ⇒ A là C4H8.
Đáp án B.

Đáp án A
Crackinh V lít C4H10 → hhX gồm 5 hiđrocacbon.
3X + 1H2 → hhY. Dẫn Y qua xt Ni/to
→ hhZ gồm 4 hiđrocacbon có V giảm 25% so với Y.
Z không có khả năng làm mất màu dd Br2 → Z là hh ankan và H2 dư.
• Giả sử có 3 mol X + 1 mol H2.
Vì hhZ gồm 4 hiđrocacbon và có thể tích giảm 25% so với ban đầu
→ nH2phản ứng = 4 x 25% = 1 mol → nanken = 1 mol.
→ Trong hhY có nankan = nC4H10 dư + nCH4 + nCH3-CH3
= nC4H10 ban đầu = 2 mol
H = 1 2 = 50 %

Đáp án A
• Coi hhX ban đầu có x mol CH2=CH2 và y mol H2
Coi hh ban đầu gồm 1 mol CH2=CH2 và 3 mol H2.
• hhY gồm 0,75 mol C2H6; (1 - 0,75) mol C2H4 và (3 - 0,75) mol H2
→ ∑nY = 0,75 + (1 - 0,75) + (3 - 0,75) = 3,25 mol.
Theo BTKL: mY = mX = 1 x 28 + 3 x 2 = 34 gam
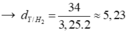

Đáp án A
hhX gồm H2 và CxHy
Nung nóng 0,85 mol hhX có xtNi
→ 25,2 gam hhY gồm các hiđrocacbon; dY/H2 = 21.
• Ta có ∑nY = 25,2 : 42 = 0,6 mol
→ nH2 = nX - nY = 0,85 - 0,6 = 0,25 mol
→ mH2 = 0,25 x 2 = 0,5 gam
Chọn đáp án C
Sử dụng sơ đồ đường chéo ⇒ nO2:nO3 = 5:3
+ Giả sử nCO2 6 mol và nH2O = 7 mol ta có sơ đồ.
+ Bảo toàn Oxi ⇒ 2nO2 + 3nO3 = 5x2a + 3x3a = 2nCO2 + nH2O = 6x2 + 7 = 19 ⇒ a = 1
⇒ Chọn C