Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{H_2SO_4}=\dfrac{200\cdot4,9\%}{98}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Cả 2 chất p/ứ hết
b+c) Theo PTHH: \(n_{ZnSO_4}=n_{H_2}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnSO_4}=0,1\cdot161=16,1\left(g\right)\\m_{H_2}=0,1\cdot2=0,2\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Zn}+m_{ddH_2SO_4}-m_{H_2}=206,3\left(g\right)\)
\(\Rightarrow C\%_{ZnSO_4}=\dfrac{16,1}{206,3}\cdot100\%\approx7,8\%\)

C% của K2SO4 = \(\frac{0,1.174}{300+0,1.174}.100\%=5,48\%\)
C% của K2SO3 = \(\frac{0,05.158}{300+0,05.158}.100\%=2,57\%\)

dd chứa 3 muối là Mg(NO3)2, Zn(NO3)2, Cu(NO3)2
=> Ag bị đẩy ra hết, Cu không bị đẩy ra hết
\(\left\{{}\begin{matrix}n_{Cu\left(NO_3\right)_2}=0,1.2=0,2\left(mol\right)\\n_{AgNO_3}=1.0,1=0,1\left(mol\right)\end{matrix}\right.\)
PTHH: Mg + 2AgNO3 --> Mg(NO3)2 + 2Ag
0,05<---0,1
Mg + Cu(NO3)2 --> Mg(NO3)2 + Cu
0,07--->0,07
Zn + Cu(NO3)2 --> Zn(NO3)2 + Cu
x---->x
Do trong dd có Cu(NO3)2
=> 0,2 - 0,07 - x > 0
=> x < 0,13
=> 0 < x < 0,13

Mg+H2SO4->MgSO4+H2
x-------------------------------x
2Al+3H2SO4->Al2(SO4)3+3H2
y-------------------------------------3\2y
Ta có :
\(\left\{{}\begin{matrix}24x+27y=11,7\\x+\dfrac{3}{2}y=0,6\end{matrix}\right.\)
=>x=0,15 mol , y=0,3 mol
=>m MgSO4=0,15.120=18g
=>m Al2(SO4)3=0,15.342=51,3g

a. nH2=4,368/22,4=0,195
Mg+2HCl->MgCl2+H2
Mg+H2SO4->MgSO4+H2
2Al+6HCl->2AlCl3+3H2
2Al+3H2SO4->Al2(SO4)3+3H2
Theo phương trình nH2=nHCl/2+nH2SO4
Nếu axit hết
->nH2=nHCl/2+nH2SO4
->nH2=0,25/2+0,125=0,25>0,195
->Axit phải dư
b. Gọi số mol Mg và Al là a và b
Ta có 24a+27b=3,87
Theo pt : nH2=nMg+1,5nAl
->0,195=a+1,5b
->a=0,06; b=0,09
->%mMg=0,06.24/3,87=37,21%
->%mAl=62,79%
HT

Bài 10:
- Giả sử có 100 gam dd H2SO4 98%
\(m_{H_2SO_4}=\dfrac{100.98}{100}=98\left(g\right)\) => \(n_{H_2SO_4}=\dfrac{98}{98}=1\left(mol\right)\)
\(V_{dd.H_2SO_4.98\%}=\dfrac{100}{1,84}=\dfrac{1250}{23}\left(ml\right)=\dfrac{5}{92}\left(l\right)\)
\(C_{M\left(dd.H_2SO_4.98\%\right)}=\dfrac{1}{\dfrac{5}{92}}=18,4M\)
\(n_{H_2SO_4}=18,4.0,05=0,92\left(mol\right)\)
=> \(m_{H_2SO_4}=0,92.98=90,16\left(g\right)\)
=> \(m_{dd.H_2SO_4.10\%}=\dfrac{90,16.100}{10}=901,6\left(g\right)\)
Bài 11:
a) Do dd sau pư có 3 chát tan với nồng độ % bằng nhau
=> \(m_{Al_2\left(SO_4\right)_3}=m_{ZnSO_4}=m_{H_2SO_4\left(dư\right)}\)
Gọi số mol Al, Zn là a, b (mol)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
a----->1,5a------->0,5a----->1,5a
Zn + H2SO4 --> ZnSO4 + H2
b----->b--------->b----->b
=> \(\left\{{}\begin{matrix}m_{Al_2\left(SO_4\right)_3}=342.0,5a=171a\left(g\right)\\m_{ZnSO_4}=161b\left(g\right)\end{matrix}\right.\)
=> 171a = 161b
=> \(\dfrac{a}{b}=\dfrac{161}{171}\) (1)
Có: \(\dfrac{m_{Al}}{m_{Zn}}=\dfrac{27.n_{Al}}{65.n_{Zn}}=\dfrac{27}{65}.\dfrac{161}{171}=\dfrac{483}{1235}\)
b) \(n_{H_2}=1,5a+b=\dfrac{11,2}{22,4}=0,5\left(mol\right)\) (2)
(1)(2) => \(\left\{{}\begin{matrix}a=\dfrac{161}{825}\left(mol\right)\\b=\dfrac{57}{275}\left(mol\right)\end{matrix}\right.\)
=> \(x=\dfrac{161}{825}.27+\dfrac{57}{275}.65=\dfrac{5154}{275}\left(g\right)\)
\(m_{H_2SO_4\left(dư\right)}=m_{Al_2\left(SO_4\right)_3}=342.0,5\dfrac{161}{825}=\dfrac{9177}{275}\left(g\right)\)
=> \(m_{H_2SO_4\left(bđ\right)}=98\left(1,5a+b\right)+\dfrac{9177}{275}=\dfrac{22652}{275}\left(g\right)\)
=> \(y=\dfrac{\dfrac{22652}{275}.100}{10}=\dfrac{45304}{55}\left(g\right)\)

*cho a g A vào H2O
nH2=0,1 mol
Ba+2H2O => Ba(OH)2 + H2
0,1<------------0,1<---------0,1
*cho a g A vào HClo dư
nH2 =0,2 mol
Ba+2HCl=> BaCl2 + H2
0,1----------->0,1------->0,1
Mg + 2HCl=> MgCl2 + H2
0,1<--------------0,1<--0,2-0,1
=> a= 0,1.137 +0,1.24 = 16,1(g)
BaCl2 + H2SO4=> BaSO4 + 2HCl
0,1--------->0,1
0,3mol NaOH +0,1mol MgCl2 => NaOH dư
MgCl2 + 2NaOH=> 2NaCl + Mg(OH)2
0,1------->0,2------------------->0,1
=> m tủa 0,1.233+0,1.58=29,1(g)
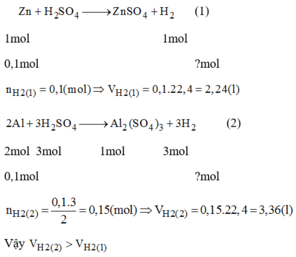


Ag và Cu không tác dụng được với H2SO4 loãng
Zn+H2SO4---->ZnSO4+H2
Muối sau pư chỉ có ZnSO4
Theo pthh
n ZnSO4=n Zn=0,1(mol)
m ZnSO4=0,1.161=16,1(g)
n H2=n Zn=0,1(mol)
m H2=0,2(g)
m dd sau pư=6,5+200-0,2=206,3(g)
C% ZnSO4=16,1/206,3.100%=7,8%
Zn + H2SO4 -> ZnSO4 + H2
0,1___0,1_____0,1___0,1(mol)
mZnSO4= 161.0,1= 16,1(g)
mddZnSO4= mZn+ mddH2SO4- mH2= 0,1 . 65+200- 0,1.2= 206,3(g)
=> C%ddZnSO4= (16,1/206,3).100=7,804%