
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chất rắn không tan là Vàng $\Rightarrow m_{Au} = 1,97(gam)$
Gọi $n_{Cu} = a(mol) ; n_{Ag} = b(mol) \Rightarrow 64a + 108b = 6,05 - 1,97(1)$
$n_{NO_2} = \dfrac{1,792}{22,4} = 0,08(mol)$
Bảo toàn e : $2a + b = 0,08(2)$
Từ (1)(2) suy ra : a = 0,03 ; b = 0,02
$\%m_{Au} = \dfrac{1,97}{6,05}.100\% = 32,6\%$
$\%m_{Cu} = \dfrac{0,03.64}{6,05}.100\% = 31,7\%$
$\%m_{Ag} = 100\% - 32,6\% - 31,7\% = 36,7\%$

Chọn B
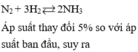
Áp suất thay đổi 5% so với áp suất ban đầu => n s a u n t r ư ớ c = 95 100
Giả sử trước phản ứng có 1 mol => sau phản ứng có 0,95 mol
ntrước – nsau = 2nN2 pư = 0,05 mol
è nN2 ban đầu = 0,025:10% = 0,25 =>%nN2 = 25%

Theo đề bài ta có hệ phương trình:
\(\left\{{}\begin{matrix}\dfrac{x}{y}+\dfrac{y}{2}=\dfrac{6,72}{22,4}=0,3\\331y=16,55\end{matrix}\right.\)
Giải ra ta được :
x = 0,55
y = 0,05
=> \(mC_2H_5OH=0,55.46=25,3\left(g\right)\)
=> \(mC_6H_5OH=0,05.94=4,7\left(g\right)\)
=> \(\%m_{C_2H_5OH}=\dfrac{25,3.100}{25,3+4,7}=84,33\%\)
=> \(\%m_{C_6H_5OH}=100-84,33=15,67\%\)

Gọi $n_{Fe} = a(mol) ; n_{Zn} = b(mol) \Rightarrow 56a + 65b = 1,77(1)$
$n_{NO_2} = \dfrac{1,792}{22,4} = 0,08(mol)$
Bảo toàn electron :
$3n_{Fe} + 2n_{Zn} = n_{NO_2} \Rightarrow 3a + 2b = 0,08(2)$
Từ (1)(2) suy ra: a = 0,02 ; b = 0,01
$\%m_{Fe} = \dfrac{0,02.56}{1,77}.100\% = 63,3\%$
$\%m_{Zn} =100\% - 63,3\% = 36,7\%$

\(n_{Br_2}=\dfrac{8}{160}=0.05\left(mol\right)\)
\(C_nH_{2n}+Br_2\rightarrow C_nH_{2n}Br_2\)
\(0.05.........0.05\)
\(M_A=\dfrac{1.4}{0.05}=28\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow14n=28\)
\(\Rightarrow n=2\)
\(CTPT:C_2H_4\)
\(\Rightarrow etilen\)
\(b.\)
\(V_{CH_4}=1.12\left(l\right)\)
\(\Rightarrow V_{C_2H_4}=4.48-1.12=3.36\left(l\right)\)
\(\%V_{CH_4}=\dfrac{1.12}{4.48}\cdot100\%=25\%\)
\(\%V_{C_2H_4}=75\%\)

