Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Xét X là F:
CH4(g) + F2(g) → CH3F(g) + HF(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (F2) - 1 x Eb (HF) - x Eb (CH3F)
∆rH0298 = 1 x 4EC-H + 1 x EF-F - 1 x EH-F - 1 x (3EC-H + EC-F)
∆rH0298 = 1x4 x414 + 1x159– 1x565 - 1x(3x414 + 1x485)= -477kJ
- Xét X là Cl:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (Cl2) - 1 x Eb (HCl) - x Eb (CH3Cl)
∆rH0298 = 1 x 4EC-H + 1 x ECl-Cl - 1 x EH-Cl - 1 x (3EC-H + EC-Cl)
∆rH0298 = 1x4 x414 + 1x243– 1x431 - 1 x(3x414 + 1x339)= -113kJ
- Xét X là Br:
CH4(g) + Br2(g) → CH3Br(g) + HBr(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (Br2) - 1 x Eb (HBr) - x Eb (CH3Br)
∆rH0298 = 1 x 4EC-H + 1 x EBr-Br - 1 x EH-Br - 1 x (3EC-H + EC-Br)
∆rH0298 = 1x4 x414 + 1x193– 1x364 - 1 x(3x414 + 1x276)= -33kJ
- Xét X là I:
CH4(g) + I2(g) → CH3I(g) + HI(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (I2) - 1 x Eb (HI) - x Eb (CH3I)
∆rH0298 = 1 x 4EC-H + 1 x EI-I - 1 x EH-I - 1 x (3EC-H + EC-I)
∆rH0298 = 1x4 x414 + 1x151– 1x297 - 1 x(3x414 + 1x240)= 28kJ
=> Từ F đến I, tính phi kim giảm dần nên khả năng tham gia phản ứng giảm dần

a)Phản ứng sản xuất NH3 là phản ứng tỏa nhiệt, lượng nhiệt tỏa ra dùng để đốt nóng hỗn hợp N2 và H2 cho phản ứng tiếp tục xảy ra
=> Tiết kiệm nhiên liệu đốt cho quá trình phản ứng
b) N2(g) + 3H2(g) → 2NH3(g) ${\Delta _r},H_{298}^0$= -92,22 kJ
Ta có: -92,22 = 2 x ∆fH0298 (NH3) – 1 x ∆fH0298 (N2) - 3 x ∆fH0298 (H2)
=> -92,22 = 2 x ∆fH0298 (NH3) – 0 – 0
=> ∆fH0298 (NH3) = -46,11 kJ

Gọi nhiệt tạo thành chuẩn của khí methane là x
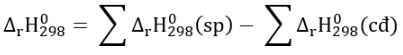
\(\rightarrow\) -890,3 = 2.(-285,8) -393,5 - x - 2.0
\(\rightarrow\) x = – 74,8 kJ/mol
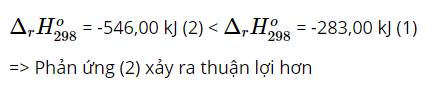
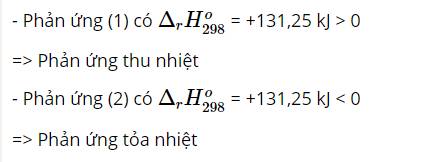


Giả sử: 1 gam C và Al
+ 1 gam C có 1/12 mol
1 mol C : ${\Delta _r},H_{298}^0$ = -393,5 kJ
1/12 mol C ${\Delta _r},H_{298}^0$ = -32,79 kJ
+ 1 gam Al có 1/27 mol
2 mol Al : ${\Delta _r},H_{298}^0$= -1675,7 kJ
1/27mol Al : ${\Delta _r},H_{298}^0$= -31,03 kJ
⇒ Với cùng một khối lượng C và Al, C khi đốt cháy tỏa ra nhiều nhiệt hơn.