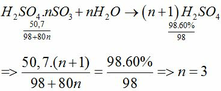Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2SO4 = 1,8mol
H2SO4 + 3SO3 → H2SO4.3SO3 (oleum)
1,8 → 5,4
m = 5,4 . 80 = 432g

Bài 1 :
Theo đề bài ta có : \(nSO2=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Ta có : mdd = \(V.D=500.1,2=600\left(g\right)\) => nKOH=\(\dfrac{600.7,467}{56.100}\approx0,8\left(mol\right)\)
\(Ta-c\text{ó}-PTHH\)
\(SO2+2KOH\rightarrow K2SO3+H2O\)
0,3mol....0,6mol......0,3mol
Theo PTHH ta có : \(nSO2=\dfrac{0,3}{1}mol< nKOH=\dfrac{0,8}{2}mol\) => nKOH dư ( tính theo nSO2)
Ta có : \(\left\{{}\begin{matrix}C\%_{KOH\left(d\text{ư}\right)}=\dfrac{\left(0,8-0,6\right).56}{0,3.64+600}.100\%\approx1,809\%\\C\%_{K2SO3}=\dfrac{0,3.158}{0,3.64+600}.100\%\approx7,66\%\\CM_{K2SO3}=\dfrac{0,3}{0,5}=0,6\left(M\right)\\V\text{ậy}.....................................\end{matrix}\right.\)
Trên mạng có một bài tương tự như bài 2 nha
Bài 3 : Gọi CTHHTQ của oleum là H2SO4.nSO3 và Số mol của nSO3 là x mol
Theo đề bài ta có : nNaOH = 0,5.0,016=0,008(mol)
Ta có :
\(nSO3+H2SO4\rightarrow H2SO4.nSO3\)
x mol............................... xmol
\(H2SO4.nSO3+H2O\rightarrow\left(n+1\right)H2SO4\)
xmol...................................................(n+1)xmol
Ta có PTHH trung hòa H2SO4 bằng NaOH
2NaOH + H2SO4 \(\rightarrow\) Na2SO4 + 2H2O
x(n+1)mol.....\(\dfrac{x\left(n+1\right)}{2}\)mol
Số gam của oleum là bao nhiêu vậy bạn . Bạn xem laị đề đi nhé và sau đó làm theo phía trên là được

- Ôleum hoặc acid sulfuric bốc khói đều nói về một dạng cấu thành khác của lưu huỳnh triốxit trong axít sulfuric hoặc đôi khi cụ thể hơn để acid disulfuric (còn gọi là acid pyrosulfuric).
- Oleums có thể được mô tả bởi công thức ySO3 . H2O trong đó y là tổng số mol lưu huỳnh triốxit bên trong. Giá trị của y có thể được đa dạng do đó có nhiều loại oleums khác nhau.
Chúng cũng có thể được mô tả bằng công thức H2SO4.xSO3 (bây giờ) với x là số mol lưu huỳnh triôxit tự do bên trong.
- Công thức của oleum nói chung được tính theo khối lượng của SO3 bên trong. Giá trị x = 1 cho chúng ta công thức H2S2O7 là acid (pyrosulfuric) disulfuric. Acid disulfuric tinh khiết là chất rắn ở nhiệt độ phòng, nóng chảy ở 36 ° C và ít được sử dụng trong các phòng thí nghiệm hoặc các quá trình công nghiệp.
* Gọi CT của oleum là H2SO4.xSO3 (với x > 0)
2NaOH + H2SO4 = Na2SO4 + H2O
0,008 ------> 0,004
∑ n H2SO4 = 0,004*10 = 0,04
H2SO4.xSO3 + xH2O = (x+1)H2SO4
0,04/(x+1) <--------------------0,04
=> M H2SO4.xSO3 = 3,38 / 0,04/(x+1) = 84,5 (x+1)
Do m € Z => x + 1 chia hết cho 2 => x lẻ và x > 1
cho x = 3 => CT là H2SO4.3SO3 và M = 338 (thỏa mãn)
cho x = 5 => CT là H2SO4.5SO3 < M = 507 (loại)
vậy CT của oleum là H2SO4.3SO3

Tham khảo
Khối lượng oleum chứa 71% SO3 về khối lượng cần lấy để hòa tan vào 100 gam dung dịch H2SO4 60% thì thu được oleum chứa 30% SO3 về khối lượng là:
A. 506,78gam B. 312,56 gam C. 539,68gam D. 496,68gam
Giải
x mol SO3 ,m g oleum -->80x/m = 0,71
mH2O=40 g--->nH2O=20/9 mol
SO3 + H2O--->H2SO4
--> n SO3 dư =x-20/9 ----> 80(x-20/9)/(m+100)=0,3
---->m=506,78gam