Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì các phản ứng hoàn toàn mà khi cho Y + NaOH ----> H2 chứng tỏ Al dư, Fe2O3 chuyển hết thành Fe. Vậy trong Y có chứa Al: 0,03 mol ( nH2 = 3/2nAl); nFe = 0,06 mol (mFe = m rắn = 3,36 g)
Từ pư: 2Al + Fe2O3 ---> Al2O3 + 2Fe => nFe2O3 = nAl2O3, mà nFe2O3 = nFe/2 => nAl2O3 = 0,03 mol
m phần 1 = 7,23 g => m phần 2 = 21,69 g. Hay p2 = 3 p1
=> Trong phần 2 có: Al: 0,09 mol; Fe: 0,18 mol; Al2O3: 0,09 mol
Bảo toàn e (giả sử chỉ tạo Fe2+, vì ta chưa biết sản phẩm có Fe3+ hay không): 3nNO < 3nAl + 2nFe => có NH4+
Gọi số mol Fe2+: x, Fe3+: y, NH4+: z
=> Bảo toàn electron: 0,09.3 + 2x + 3y = 0,17.3 + 8z
x + y = 0,18 (bảo toàn Fe)
1,52 = 0,09.3.2 ( nH+ phản ứng với Al2O3) + 0,17.4 + 10z
=> x = 0,06; y = 0,12; z = 0,03
Bảo toàn N: nNO3- = nHNO3 - nNO - nNH4+ = 1,32 mol
=> m = 21,69 + NO3- = 103,53 g

Do bài không cho lượng chất cụ thể nên ta có thể tự chọn lượng chất.
Giả sử: nNaCl = 1 mol và nNaBr = a (mol)
NaCl + AgNO3 → NaNO3 + AgCl ↓
1_______1_______________ 1 (mol)
NaBr + AgNO3 → NaNO3 + AgBr ↓
a______a________________ a (mol)
Kết tủa gồm: 1 mol AgCl và a mol AgBr
Khối lượng kết tủa thu được bằng khối lượng AgNO3 pư nên ta có:
mAgCl + mAgBr = mAgNO3 pư
→ 1.143,5 + 188a = 170.(1 + a)
→ a = \(\frac{53}{36}\)
\(\%m_{NaCl}=\frac{58,5.1}{58,5.1+103.\frac{53}{36}}.100\%=27,84\%\)
\(\%m_{NaBr}=100\%-27,84\%=72,16\%\)

a)
Gọi số mol Fe, Cu là a, b (mol)
=> 56a + 64b = 12 (1)
\(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
a------------------------------->1,5a
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
b---------------------------->b
=> 1,5a + b = 0,25 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> mFe = 0,1.56 = 5,6 (g)
b)
1 nửa hỗn hợp X trên chứa \(\left\{{}\begin{matrix}Fe:0,05\left(mol\right)\\Cu:0,05\left(mol\right)\end{matrix}\right.\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,05---------------------->0,05
=> Thu được khí H2
VH2 = 0,05.22,4 = 1,12 (l)

nZn=0,3 mol; \(n_{H_2SO_4} = 0,4 mol\)
\(\begin{array}{l} Zn \to Z{n^{2 + }} + 2{\rm{e}}\\ 0,3\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,6\,mol \end{array} \)
Bảo toàn S: \({n_{\mathop S\limits^x }} = {n_{{H_2}S{O_4}}} - {n_{Zn{\rm{S}}{O_4}}} = 0,4 - 0,3 = 0,1\,mol\)
\(\begin{array}{l} \mathop S\limits^{ + 6} \, + \,(6 - x)e \to \mathop S\limits^x \\ 0,1\,\,\,\,\,\,\,\,\,0,6\,mol \end{array}\)
\(\rightarrow x=0\)
\(\rightarrow\) Sản phẩm khử là S.

\(2NaI+Cl_2\to 2NaCl+I_2\)
Đặt \(n_{NaI}=x(mol)\Rightarrow n_{NaCl}=x(mol)\)
\(\Rightarrow m_{dd giảm}=m_{NaI}-m_{NaCl}=150x-58,5x=9,15\\ \Rightarrow x=0,1(mol)\\ \Rightarrow m_{NaI}=0,1.150=15(g)\)



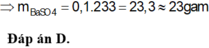
`@` Trong phản ứng giữa đá vôi `(CaCO_3)` và axit clohidric `(HCl)`, xảy ra phản ứng trao đổi, tạo ra muối canxi clorua `(CaCl_2)`, khí cacbon dioxide `(CO_2)` và nước `(H_2O)` theo phương trình hóa học sau:
`CaCO_3 + 2HCl → CaCl_2 + CO_2 + H_2O`
`@` Trong quá trình phản ứng, các phân tử của axit clohidric tác động lên các phân tử của đá vôi, gây ra sự phân hủy của chúng. Cụ thể, axit clohidric tác động lên ion canxi trong đá vôi, tạo ra muối canxi clorua và giải phóng khí cacbon dioxide.
`@` Vì khối lượng của khí `CO_2` thoát ra khỏi hỗn hợp phản ứng, nên khối lượng của sản phẩm tạo thành ít hơn khối lượng ban đầu của chất tham gia. Điều này được giải thích bởi định luật bảo toàn khối lượng, theo đó khối lượng của các chất tham gia phải bằng khối lượng của các sản phẩm tạo thành. Tuy nhiên, trong trường hợp này, khối lượng của sản phẩm tạo thành ít hơn khối lượng ban đầu của chất tham gia do khí `CO_2` thoát ra khỏi hỗn hợp phản ứng.
`=>` Khối lượng của chất tham gia lớn hơn khối lượng của sản phẩm tạo thành trong phản ứng giữa đá vôi và axit clohidric.