Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 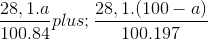 = 0,2
= 0,2
=> a = 29,89.

k61 = 1/9600.ln(0,1/0,0854) = 1,644.10-5 (phút-1), k71 = 1/9600.ln(0,1/0,056) = 6,04.10-5 (phút-1).
Bạn Hằng phát hiện đúng rồi đấy.

Bài giải:
- Vì =
=>
=
, suy ra polime đó là polietilen (-CH2 – CH2 - )n.
- Không thể là tinh bột (-C6H10O5-)n, vì có tỉ lệ =
, cũng không thể là PVC vì chất này khi cháy phải có sinh ra hợp chất chứa clo.

bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với
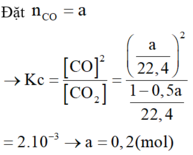
 = 1,644.10-5 (s-1); k71 = 6,040.10-5 (s-1);
= 1,644.10-5 (s-1); k71 = 6,040.10-5 (s-1); 
Đáp án : D
C(r) + CO2 (k) ó 2CO (k)
Bđ 0,2 1 22 , 4 0 M
Pứ x 2x M
CB 1 22 , 4 - x 2x M
=> K c = C O 2 C O 2 = 2 x 2 1 22 , 4 - x = 2 . 10 - 3
=> x = 4,45.10-3 M
=> nCO = 2x.22,4 = 0,2 mol
=> D