Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Phản ứng giữa nitrogen và hydrogen cần được thực hiện ở nhiệt độ cao do liên kết ba giữa 2 nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (945 kJ/ mol) nên khó bị phá vỡ.
- Phương trình hoá học:
\({\mathop {\rm{N}}\limits^{\rm{0}} _{\rm{2}}}{\rm{(g) + 3}}{{\rm{H}}_{\rm{2}}}\)⇌ \({\rm{2}}\mathop {\rm{N}}\limits^{{\rm{ - 3}}} {{\rm{H}}_{\rm{3}}}\)
Số oxi hoá của nitrogen giảm từ 0 xuống -3 nên trong phản ứng này đơn chất nitrogen đóng vai trò là chất oxi hoá.

2.
\(\dfrac{1}{2}N_2+\dfrac{3}{2}H_2-t^0->NH_3\)
N có số oxy hoá thay đổi từ 0 sang -3; H có số oxy hoá từ 0 sang +1.
3.
N2(g) + O2(g) ⇌ 2NO(g)
a. N có số oxy hoá thay đổi từ 0 sang +2; O có số oxy hoá từ 0 sang -2.
b. Vì đây là phản ứng cần năng lượng cao mà hiệu suất kém, đi kèm với lãng phí, tiêu hao nhiên liệu.

\(NH_3+HCl->NH_4Cl\)
Vì ammonia là chất nhận proton nên nó là base.

+ Xét phản ứng: NH3 + HCl → NH4Cl
Chất cho proton là HCl, chất nhận proton là NH3:
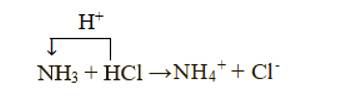
+ Xét phản ứng: NH3 + HNO3 → NH4NO3
Chất cho proton là HNO3, chất nhận proton là NH3:
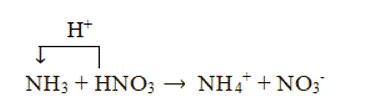
+ Xét phản ứng: 2NH3 + H2SO4 → (NH4)2SO4
Chất cho proton là H2SO4, chất nhận proton là NH3:
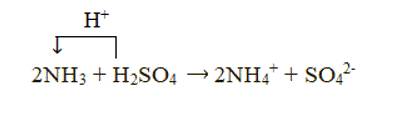

Đáp án C
P thể hiện tính oxi hóa khi tác dụng với chất khử, số oxi hóa giảm sau phản ứng
![]()
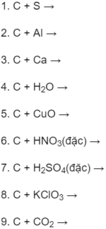


P.ứ với acid : Tính base
P.ứ với oxy: Tính khử