Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nC6H5Br = 0,1 mol
C6H6 + Br2 → C6H5Br + HBr
0,1<-------------0,1
⇒ mC6H6 = 0,1.78.\(\dfrac{100}{65}\) = 12 (g)

Phương trình hoá học của phản ứng giữa benzen và clo
C 6 H 6 + Cl 2 → t ° C 6 H 5 Cl + HCl
Theo phương trình hoá học : số mol C 6 H 6 = số mol C 6 H 5 Cl
Vì hiệu suất 80% và clo dư nên số mol clobenzen thu được là :
n C 6 H 5 Cl = 15,6/78 x 80/100 = 0,16mol
=> m C 6 H 5 Cl = 0,16 x 112,5 = 18g

\(n_{C_6H_5Cl}=\dfrac{78}{112,5}=\dfrac{52}{75}\left(mol\right)\)
\(n_{C_6H_6}=\dfrac{78}{78}=1\left(mol\right)\)
PTHH:
\(C_6H_6+Cl_2\xrightarrow[t^o]{Fe}C_6H_5Cl\)
1------------------>1
\(\Rightarrow H=\dfrac{\dfrac{52}{75}}{1}.100\%=69,33\%\)

Lời giải:
=
= 0,1 mol.
a) Phương trình phản ứng:
C6H6Br + Br2 C6H5Br + HBr
P.ư: 0,1 0,1 0,1 (mol)
b) Khối lượng bezen phản ứng: 0,1 x 78 = 7,8 gam.
Vì hiệu suất hay lượng phản ứng chỉ đạt 80% nên:
Khối lượng benzen cần dùng: 7,8 x = 9,75 gam.

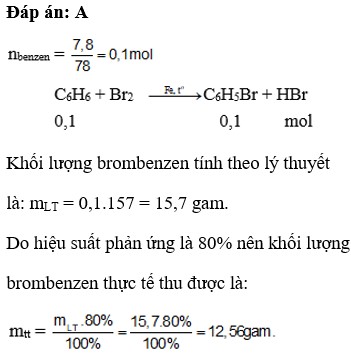


\(C6H6+Br2-->C6H5Br+HBr\)
\(n_{C6H5Br}=\frac{47,1}{157}=0,3\left(mol\right)\)
\(n_{C6H6}=n_{C6H5Br}=0,3\left(mol\right)\)
\(m_{C6H6}=0,3.78=23,4\left(g\right)\)
H%=80%
=>\(m_{C6H6}=23,4.80\%=18.,72\left(g\right)\)