Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo gt ta có: $n_{Na_2SO_4}=0,07(mol);n_{Ba(OH)_2}=0,48(mol)$
$Na_2SO_4+Ba(OH)_2\rightarrow BaSO_4+2NaOH$
Sau phản ứng dung dịch chứa 0,41 mol $Ba(OH)_2$ dư và 0,14 mol $NaOH$
Bảo toàn khối lượng ta có: $m_{dd}=9,94+400-0,07.233=393,63(g)$
$\Rightarrow \%C_{Ba(OH)_2}=17,81\%;\%C_{NaOH}=1,42\%$
Số mol của muối natri sunfat
nNa2SO4 = \(\dfrac{m_{Na2SO4}}{M_{Na2SO4}}=\dfrac{9,94}{142}=0,07\left(mol\right)\)
Khối lượng của bari hidroxi C0/0Ba(OH)2 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{20,52.400}{100}=82,08\left(g\right)\)
Số mol của bari hidroxit
nBa(OH)2 = \(\dfrac{m_{Ba\left(OH\right)2}}{M_{Ba\left(OH\right)2}}=\dfrac{82,08}{171}=0,48\left(mol\right)\)
Pt : Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH\(|\)
1 1 1 2
0,07 0,48 0,07 0,14
a) Lập tỉ số so sánh : \(\dfrac{0,07}{1}< \dfrac{0,48}{1}\)
⇒ Na2SO4 phản ứng hết , Ba(OH)2 dư
⇒ Tính toán dựa vào số mol Na2SO4
Số mol của bari sunfat
nBaSO4 = \(\dfrac{0,07.1}{1}=0,07\left(mol\right)\)
Khối lượng của bari sunfat
mBaSO4 = nBaSO4 . MBaSO4
= 0,07 . 233
= 16,31 (g)
b) Các chất có trong dung dịch A là : Ba(OH)2 dư và NaOH
Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,07.2}{1}=0,14\left(mol\right)\)
Khối lượng của dung dịch natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,14 . 40
= 5,6 (g)
Số mol dư của dung dịch bari hidroxit
ndư = nban đầu - nmol
= 0,48 - (0,07 . 1)
= 0,41 (mol)
Khối lượng dư của dung dịch bari hidroxit
mdư = ndư . MBa(OH)2
= 0,41 . 171
= 70,11 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mNa2SO4 + mBa(OH)2 - mBaSO4
= 9, 94 + 400 - 16,31
= 393,63 (g)
Nồng độ phần trăm của dung dịch natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{5,6.100}{393,63}=1,42\)0/0
Nồng độ phần trăm của dung dịch bari hidroxit
C0/0Ba(OH)2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{70,11.100}{393,63}=17,81\)0/0
Chúc bạn học tốt

\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: BaCO3 + 2HCl --> BaCl2 + CO2 + H2O
0,1<------0,2<-----0,1<----0,1
=> \(n_{BaO}=\dfrac{35-0,1.197}{153}=0,1\left(mol\right)\)
PTHH: BaO + 2HCl --> BaCl2 + H2O
0,1---->0,2----->0,1
=> mHCl = (0,2 + 0,2).36,5 = 14,6 (g)
=> \(m_{dd.HCl}=\dfrac{14,6.100}{14,6}=100\left(g\right)\)
mdd sau pư = 35 + 100 - 0,1.44 = 130,6 (g)
\(C\%_{BaCl_2}=\dfrac{\left(0,1+0,1\right).208}{130,6}.100\%=31,853\%\)

a) Đặt : nAl=a(mol); nFe=b(mol)
PTHH: 2Al + 6 HCl -> 2 AlCl3 + 3 H2 (1)
a_________3a______a______1,5a(mol)
Fe +2 HCl -> FeCl2 + H2 (2)
b_____2b_____b____b(mol)
Ta lập hpt:
\(\left\{{}\begin{matrix}27a+56b=8,3\\1,5a+b=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
b) nHCl(p.ứ)=3a+2b=0,5(mol) => nHCl(lấy)=0,55(mol)
=>mHCl(lấy)=0,55.36,5=20,075(g)
=>C%ddHCl(lấy)=(20,075/100).100=20,075%
c) mddsau= mhh + mddHCl - mH2= 8,3+ 100 - 0,25.2= 107,8(g)
mAlCl3=0,1.133,5=13,35(g); mFeCl2= 0,1.127=12,7(g)
=>C%ddAlCl3= (13,35/107,8).100=12,384%
C%ddFeCl2=(12,7/107,8).100=11,781%
d) AlCl3 + 3 NaOH -> Al(OH)3 + 3 NaCl
0,1_____0,3______0,1______0,3(mol)
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
0,1____0,2_______0,1______0,2(mol)
2 Al(OH)3 -to-> Al2O3 + 3 H2O
0,1________0,05(mol)
Fe(OH)2 -to-> FeO + H2O
0,1_______0,1(mol)
m=m(ket tua)= mFe(OH)2+ mAl(OH)3= 0,1. 90+ 0,1.78= 16,8(g)
a=m(rắn)= mFeO + mAl2O3= 0,1.72+ 0,05.102= 12,3(g)
Chúc em học tốt!

Dung dịch X có thể td được vừa hết với 0,08 mol NaOH hoặc 0,1 mol HCl
Suy ra Na2CO3 phải còn dư vì nếu Na2CO3 hết thì tỷ lệ NaOH và HCl phải bằng nhau
Na2CO3 + Ba(HCO3)2 --> 2NaHCO3 + BaCO3 (1)
x mol----------x----------------------2x--...
n (Na2CO3 dư) = y mol
CaCO3: zmol
dd X: NaHCO3 2x mol; Na2CO3 ymol
NaHCO3 + NaOH --> Na2CO3 + H2O (2)
---> 2x = 0,08 mol
--> x = 0,04 mol
NaHCO3 + HCl --> NaCl + H2O + CO2 (3)
2x mol-------2x
Na2CO3 + 2HCl ---> 2NaCl + H2O + CO2 (4)
y mol-------2y
từ pt 3 4 suy ra 2y = 0,02
--> y - 0,01 mol
Nên Na2CO3 ban đầu 0,05 mol
rắn Y CaCO3 zmol và BaCO3 x mol
CaCO3 + 2 HCl ---> CO2 + CaCl2 + H2O (5)
z mol----------------------z
BaCO3 + 2 HCl ---> CO2 + BaCl2 + H2O (6)
x mol----------------------x
n (CO2) = x + z mol
Ca(OH) + CO2 --> CaCO3 + H2O (7)
---> x + z = 0,16 mol
---> z = 0,12 mol
Tóm lại trong A có
Na2CO3 0,05 mol
CaCO3 0,12 mol
bạn tự làm tiếp nhé
Chúc bạn học tốt!

Sửa đề: 10,23g CuO và PbO
Bảo toàn Cacbon: \(n_{CO_2}=n_{CaCO_3}=\dfrac{11}{100}=0,11\left(mol\right)\)
PTHH: \(CuO+CO\xrightarrow[]{t^o}Cu+CO_2\)
a_________________a (mol)
\(PbO+CO\xrightarrow[]{t^o}Pb+CO_2\)
b_________________b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}80a+223b=10,23\\a+b=0,11\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,01\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1\cdot80}{10,23}\cdot100\%\approx78,2\%\\\%m_{PbO}=21,8\%\end{matrix}\right.\)
a) \(PbO+CO-^{t^o}\rightarrow Pb+CO_2\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
b) \(n_{kt}=n_{CO_2}=0,11\left(mol\right)\)
\(n_{PbO}=n_{CO_2}=0,11\left(mol\right)\)
=> \(\%m_{PbO}=\dfrac{0,11.223}{10,23}.100=239,78\)%
Đề sai :D

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

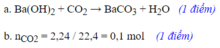

\(n_{Na_2SO_4}=\dfrac{9,94}{142}=0,07\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{100.20,52\%}{171}=0,12\left(mol\right)\)
\(Na_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2NaOH\)
0,07..........0,12
Lập tỉ lệ : \(\dfrac{0,07}{1}< \dfrac{0,12}{1}\) => Sau phản ứng Ba(OH)2 dư
=> \(m_{BaSO_4}=0,07.233=16,31\left(g\right)\)
Dung dịch A gồm Ba(OH)2 dư, NaCl
\(C\%_{Ba\left(OH\right)_2\left(dư\right)}=\dfrac{\left(0,12-0,07\right).171}{9,94+100-16,31}.100=9,13\%\)
\(C\%_{NaOH}=\dfrac{0,07.2.40}{9,94+100-16,31}.100=5,98\%\)
Bạn tham khảo nhé !