Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Zn+2HCl->Zncl2+H2
0,1-------------------0,1
n Zn=0,1 mol
=>VH2=0,1.22,4=2,24l
=>C

$2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$n_{KClO_3} = \dfrac{24,5}{122,5} = 0,2(mol)$
$n_{O_2} = \dfrac{3}{2}n_{KClO_3} = 0,3(mol)$
$V_{O_2} = 0,3.22,4 = 6,72(lít)
Đáp án B
\(KClO_3-^{t^o}\rightarrow KCl+\dfrac{3}{2}O_2\)
\(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}.\dfrac{24,5}{122,5}=0,3\left(mol\right)\)
=> \(V_{O_2}=0,3.22,4=6,72\left(l\right)\)
=> Chọn B

n H 2 S O 4 = 20 % .98 98 .100 = 0 , 2 m o l 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 VH2 = 0,2.22,4 = 4,48 lít

1, 2SO2 +O2 ---->2SO3
2a <--- a --->2a
Ban đầu nSO2=0,2 mol ; nO2=0,1 mol
n khí sau=0,3-a=0,25 ⇒ a=0,05
Lúc sau có VSO2=2,24 l; VO2=1,12 l;VSO3=2,24 l
Có H=0,05/0,1.100=50%
2, 2Mg+O2 --->2MgO
0,2 <--- 0,1 --->0,2
hoà tan hh A có khí bay ra nên Mg dư, O2 hết
Trong A có mMgO=8 g; mMg dư=2,4 g

Zn+H2SO4 \(\rightarrow\) ZnSO4 + H2
0,2 \(\leftarrow\) 0,2
a) nH2 = 4,48/22,4 =0,2 (mol)
\(\Rightarrow\) nZn = 0,2(mol) \(\Rightarrow\) mZn = 65 * 0,2 =13 (g)

Câu 2: Cho thanh Al ngâm vào dung dịch axit clohidric thấy có khí bay lên. Xác định khí đó
A. H2O B. H2 C.Cl2 D. NH3
Câu 3: Cho 2,4 g Mg vào dung dịch H2SO4 thì thể tích khí H¬2 thoát ra (đktc) là:
A. 2,24 lít; B. 2 lít C. 4,48 lít. D. 4 lít.
Câu 4: Cho biết ở 200 C độ tan của NaCl là 32g để được dung dịch NaCl bão hòa ở nhiệt độ này ta cần:
A. Lấy 32g NaCl và 68g nước cất B. Lấy 32g NaCl và 100g nước cất.
C. Lấy 32g nước cất và 100g NaCl D. Lấy 132g NaCl và 100g nước cất.
Câu 5: Dãy oxit nào đều tác dụng được với nước?
A. SO2, CaO, P2O5, ZnO; B. SO3, CuO, P2O5, Na2O;
C. SO3, CaO, P2O5, Na2O; D. SO3, ZnO, P2O5, Na2O;
Câu 6: Dung dịch bazơ làm giấy quỳ tím chuyển sang màu
A. vàng B. xanh C. Đỏ D. không đổi màu
Câu 8: cách pha chế nước muối sinh lý 5% ta cần:
A. Lấy 5g NaCl và 95g nước cất C. Lấy 0,5g NaCl và 95g nước cất
B. Lấy 0,5g NaCl và 95 ml nước cất D. Lấy 5g NaCl và 90ml nước cất
Câu 9: Hòa tan 40g đường với nước được dung dịch đường 20%. Tính khối lượng dung dịch đường thu được
A. 170 gam B. 200 gam C. 150 gam D. 250 gam

câu 1: nAl=0,4 mol
mHCL=54,75g=> nHCl=1,5 mol
PTHH: 2Al+6HCl=> 2AlCl3+3H2
0,4mol: 1,5mol => nHCl dư theo nAl
0,4mol-->1,2 mol-->0,4mol-->0,6mol
thể tích H2 là V=0,6.22,4=13,44ml
b) theo định luật btoan khối lượng ta có : mAlCl3=200+10,8-0,6.2=209,6g
m AlCl3=0,4.(27+35,5.3)=53,4g
=> C% AlCl3= 25,48%
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
Khối lượng chất tan HCl là:
200 . 27,375% = 54,75(gam)
Số mol của HCl là: 54,75 : 36,5 = 1,5 (mol)
Số mol của Al là: 10,8 : 27 = 0,4 (mol)
So sánh: \( {0,4{} \over 2}\) < \({1,5} \over 6\)
=> HCl dư, tính theo Al
Số mol của khí hiđrô sinh ra là: 0,4 . \(3 \ \over 2\) = 0,6 (mol)
V= 0,6 . 22,4 = 13,44 (lít)
Sau đó áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch A:
Khối lượng nhôm + Khối lượng dung dịch axit
= Khối lượng dung dịch A + khối lượng khí hiđrô
<=> Khối lượng dung dịch A là:
10,8 + 200 - 0,6 . 2 = 209,6 (gam)
Khối lượng chất tan AlCl3 trong dung dịch A là:
0,4 . 133,5 = 53,4 (gam)
C% chất tan trong dung dịch A là:
( 53,4 : 209,6 ) . 100% = 25,48%
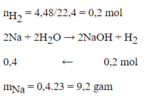


Đáp án C