Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi hóa trị của R là n
PTHH : \(2R+nH_2SO_4-->R_2\left(SO_4\right)n+nH_2\)
Theo pthh : \(n_{R2\left(SO4\right)n}=\dfrac{1}{2}n_R\)
\(\Rightarrow\dfrac{34,2}{2M_R+96n}=\dfrac{1}{2}.\dfrac{5,4}{M_R}\)
\(\Rightarrow M_R=9n\)
Ta có bảng sau :
| n | I | II | III |
| MR | 9 | 18 | 27 |
| KL | Loại | Loại | Al |
Vậy R là kim loại Al

tham khảo
Coi mdd H2SO4=100(gam)mdd H2SO4=100(gam)
⇒nH2SO4=100.9,8%98=0,1(mol)⇒nH2SO4=100.9,8%98=0,1(mol)
Gọi CTHH của muối cacbonat kim loại R hóa trị n là R2(CO3)nR2(CO3)n
R2(CO3)n+nH2SO4→R2(SO4)n+nCO2+nH2OR2(CO3)n+nH2SO4→R2(SO4)n+nCO2+nH2O
Theo phương trình ,ta có :
nCO2=nH2SO4=0,1(mol)nCO2=nH2SO4=0,1(mol)
nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)
Sau phản ứng ,
mdd=0,1n(2R+60n)+100−0,1.44=0,2Rn+101,6(gam)mdd=0,1n(2R+60n)+100−0,1.44=0,2Rn+101,6(gam)
mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)
⇒C%muối=(0,2Rn+9,6):(0,2Rn+101,6).100%=14,18%⇒C%muối=(0,2Rn+9,6):(0,2Rn+101,6).100%=14,18%
⇒R=28n⇒R=28n
Với n=1n=1 thì R=28R=28(loại)
Với n=2n=2 thì R=56(Fe)R=56(Fe)
Với n=3n=3 thì R=84R=84(loại)
Vậy kim loại R hóa trị n là FeFe hóa trị II

a, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: R + 2HCl → RCl2 + H2
Mol: 0,15 0,3 0,15
\(M_R=\dfrac{8,4}{0,15}=56\left(g/mol\right)\)
⇒ R là sắt (Fe)
b, \(m_{ddHCl}=\dfrac{0,3.36,5.100}{15}=73\left(g\right)\)

\(n_{Cl_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2R + nCl2 --> 2RCln
\(\dfrac{0,9}{n}\)<--0,45
=> \(M_R=\dfrac{8,1}{\dfrac{0,9}{n}}=9n\left(g/mol\right)\)
Xét n = 1 => MR = 9 (Loại)
Xét n = 2 => MR = 18 (Loại)
Xét n = 3 => MR = 27 (Al)
Vậy R là Al


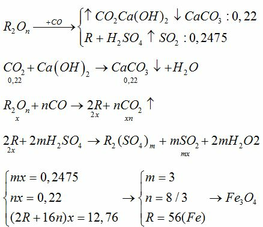
\(n_{H_2SO_4}=\dfrac{392.10\%}{98}=0,4\left(mol\right)\)
PTHH: 2R + nH2SO4 --> R2(SO4)n + nH2
\(\dfrac{0,8}{n}\)<--0,4
=> \(M_R=\dfrac{9,6}{\dfrac{0,8}{n}}=12n\left(g/mol\right)\)
Xét n = 2 thỏa mãn => MR = 24 (g/mol)
=> R là Mg
\(m_{H_2SO_4}=392.10\%=39,2\left(g\right)\)
=> \(n_{H_2SO_4}=39,2:98=0,4\left(mol\right)\)
\(pthh:R+xH_2SO_4\rightarrow R_2\left(SO_4\right)_x+xH_2\)
0,4x 0,4
=> \(M_R=9,6:0,4x=24\) (g/mol)
x=1 (T/m)
=> R là Mg