Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nAl = 5,4 / 27 = 0,2(mol)
2Al + 3H2SO4--- > Al2(SO4)3 + 3H2
0,2 0,3 0,1 0,3 (mol)
VH2SO4 = n/ CM = 0,3 / 2 = 0,15(l)
=> V1 = 150 ml
mAl2(SO4)3 = 0,1 . 342 = 34,2 (g)
Al2(SO4)3 + 3BaCl2 -- > 3BaSO4 + 2AlCl3
0,1 0,1
=> mBaSO4 = 0,1 . 233 = 23,3 (g)

\(a,n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right);n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\\ Mg+Cl_2\rightarrow\left(t^o\right)MgCl_2\\ 2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ n_{Cl_2}=n_{Mg}+1,5.n_{Al}=0,1+1,5.0,1=0,25\left(mol\right)\\ \Rightarrow V=V_{Cl_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,MgCl_2+2KOH\rightarrow Mg\left(OH\right)_2\downarrow+2KCl\\ AlCl_3+3KOH\rightarrow Al\left(OH\right)_3\downarrow+3KCl\\KT.max\Leftrightarrow Al\left(OH\right)_3.không.tan.trong.kiềm\\ n_{Mg\left(OH\right)_2}=n_{MgCl_2}=n_{Mg}=0,1\left(mol\right);n_{Al\left(OH\right)_3}=n_{AlCl_3}=n_{Al}=0,1\left(mol\right)\\ \Rightarrow m_{\downarrow\left(max\right)}=0,1.58+0,1.78=13,6\left(g\right)\)
\(n_{KOH}=2.0,1+3.0,1=0,5\left(mol\right)\\ \Rightarrow m_{KOH}=0,5.56=28\left(g\right)\\ m_{ddKOH}=\dfrac{28.100}{4}=700\left(g\right)\\ c,MnO_2+4HCl_{đặc,nóng}\rightarrow MnCl_2+Cl_2+2H_2O\\ n_{MnO_2}=n_{Cl_2}=0,25\left(mol\right)\\ \Rightarrow m_{MnO_2}=0,25.87=21,75\left(g\right)\)

Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l
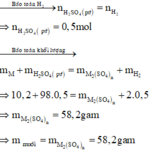

\(n_{Cu_2S}=n_{FeS}=a\left(mol\right)\\ 160a+88a=24,8\left(g\right)\\ \rightarrow n_{Cu_2S}=n_{FeS}=0,1\left(mol\right)\)
PTHH:
Cu2S + 6H2SO4 ---> 2CuSO4 + 5SO2 + 6H2O
0,1 ------> 0,6 ----------> 0,2 ------> 0,5 ------> 0,6
2FeS + 10H2SO4 ---> Fe2(SO4)3 + 9SO2 + 10H2O
0,1 ------> 0,5 -----------> 0,05 --------> 0,45 ---> 0,5
\(\rightarrow\left\{{}\begin{matrix}V_{SO_2}=\left(0,5+0,45\right).22,4=21,28\left(l\right)\\n_{H_2SO_4}=0,5+0,6=1,1\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe2(SO4)3 + 6KOH ---> 2Fe(OH)3 + 3K2SO4
0,05 ------------------------> 0,1
CuSO4 + 2KOH ---> Cu(OH)2 + K2SO4
0,2 -----------------------> 0,2
2Fe(OH)3 --to--> Fe2O3 + 3H2O
0,1 ------------------> 0,05
Cu(OH)2 --to--> CuO + H2O
0,2 ----------------> 0,2
\(\rightarrow\left\{{}\begin{matrix}m=107.0,1+98.0,2=20,5\left(g\right)\\a=0,05.160+0,2.80=24\left(g\right)\end{matrix}\right.\)

Đáp án A.
Gọi nAl = a mol, nZn = b mol.

Ta có: 27a + 65b = 9,2 (*)
3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
m muối = mKl + M gốc axit. ne/2
= 3,92 + 96. 0,25 = 33,2 g

$n_{SO_2}=\dfrac{2,24}{22,4}=0,1(mol)$
Quy hỗn hợp về $Fe:x(mol),O:y(mol)$
$\to 56x+16y=30,4(1)$
Bảo toàn e: $3n_{Fe}=2n_O+2n_{SO_2}$
$\to 3x=2y+0,2(2)$
Từ $(1)(2)\to x=0,4(mol);y=0,5(mol)$
Bảo toàn Fe: $n_{Fe_2(SO_4)_3}=0,5x=0,2(mol)$
$\to m_X=0,2.400=80(g)$

Gọi $n_{Mg} = a ; n_{Al} = b ; n_{Cu} = c$
$\Rightarrow 24a + 27b + 64c = 16,6(1)$
Thí nghiệm 1 :
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$\Rightarrow n_{H_2} = a + 1,5b = \dfrac{11,2}{22,4} = 0,5(2)$
Thí nghiệm 2 : $n_{SO_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
Bảo toàn electron :
$2a + 3b + 2c = 0,6.2(3)$
Từ (1)(2)(3) suy ra a = 0,2 ; b = 0,2 ; c = 0,1
$m_{Mg} = 0,2.24 = 4,8(gam)$
$m_{Al} = 0,2.27 = 5,4(gam)$
$m_{Cu} = 0,1.64 = 6,4(gam)$

2Al+3H2SO4 → Al2(SO4)3+3H2
Ta có:
nAl=0,26mol => nH2=1,5nAl=0,39mol
=> VH2=0,39.22,4 = 8,84l
=> nH2SO4=nH2=0,39mol
=> CMH2SO4= nV=1,95M3
BaCl2+Al2(SO4)3 → 3BaSO4+2AlCl3
nBaSO4=3nAl2(SO4)3=3.12nAl=0,39mol
=> mBaSO4=90,87g
2Al+6H2SO4 → nAl2(SO4)3+3SO2+6H2O
nAl=0,2mol
=> nSO2=1,5nAl=0,3mol
=> mSO2=19,2g