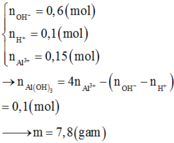Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}n_{NaOH}=0,3.2=0,6\left(mol\right)\\n_{Fe_2\left(SO_4\right)_3}=0,2.0,5=0,1\left(mol\right)\\n_{H_2SO_4}=0,2.0,5=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\left\{{}\begin{matrix}n_{Na^+}=0,6\left(mol\right)\\n_{Fe^{3+}}=0,1.2=0,2\left(mol\right)\\n_{H^+}=0,1.2=0,2\left(mol\right)\end{matrix}\right.\\\left\{{}\begin{matrix}n_{SO_4^{2-}}=0,1.3+0,1=0,4\left(mol\right)\\n_{OH^-}=0,6\left(mol\right)\end{matrix}\right.\end{matrix}\right.\)
PT ion rút gọn:
\(H^++OH^-\rightarrow H_2O\)
0,2-->0,2
\(Fe^{3+}+3OH^-\rightarrow Fe\left(OH\right)_3\downarrow\)
\(\dfrac{2}{15}\)<----0,4--------->\(\dfrac{2}{15}\)
\(\Rightarrow m=\dfrac{2}{15}.107=\dfrac{214}{15}\left(g\right)\)
dd sau phản ứng có: \(\left\{{}\begin{matrix}n_{Na^+}=0,6\left(mol\right)\\n_{Fe^{3+}\left(d\text{ư}\right)}=0,2-\dfrac{2}{15}=\dfrac{1}{15}\left(mol\right)\\n_{SO_4^{2-}}=0,4\left(mol\right)\end{matrix}\right.\)
\(V_{\text{dd}}=0,3+0,2=0,5\left(l\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{Na^+}=\dfrac{0,6}{0,5}=1,2M\\C_{Fe^{3+}}=\dfrac{\dfrac{1}{15}}{0,5}=\dfrac{2}{15}M\\C_{SO_4^{2-}}=\dfrac{0,4}{0,5}=0,8M\end{matrix}\right.\)

_Dung dịch HCl và HNO3 có pH=1:
=>[H+] = 10^-1 (mol/l)
=>Σ nH{+} = 10^-1*0.1 = 0.01(mol)
+nNaOH = 0.1a (mol)
NaOH => Na{+} + OH{-}
0.1a.........0.1a.......0.1a(mol)
=>nOH{-} = 0.1a (mol)
_Sau phản ứng thu được dung dịch có pH = 12:
+pH = 12:môi trường có tính bazơ => bazơ dư , axit hết.
+pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10^-2 (mol/l)
=>nOH{-} dư = 10^-2*0.2 = 2*10^-3 (mol)
H{+} + OH{-} => H2O
0.01....0.1a
0.01....0.01........0.01(mol)
..0....0.1a - 0.01.0.01(mol)
=>nOH{-} dư = 0.1a - 0.01 = 2*10^-3 (mol)
<=>0.1a = 0.012
<=>a = 0.12
Vậy a = 0.12 (M)

a) Ta có: \(\left\{{}\begin{matrix}n_{CuCl_2}=0,3\left(mol\right)\\n_{BaCl_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left[Cu\right]=\dfrac{0,3}{0,5}=0,6\left(M\right)\\ \Rightarrow\left[Ba\right]=\dfrac{0,1}{0,5}=0,2\left(M\right)\\ \Rightarrow\left[Cl\right]=\dfrac{0,3.2+0,1.2}{0,5}=1,6\left(M\right)\)

nNaHCO3= 0,2 mol⇒ nHCO3= 0,2 mol
nK2CO3= 0,2 mol⇒ nCO3= 0,2 mol
nH2SO4= 0,1 mol
nHCl= 0,1 mol
⇒∑nH+= 0,1.2+0,1=0,3 mol
PT:\(CO3^{2-}+H^+\rightarrow HCO3^-\)
____0,2____0,2______0,2
\(HCO3^-+H^+\rightarrow CO2+H2O\)
0,1______________0,1__0,1
⇒nHCO3= 0,2+0,2- 0,1= 0,3 mol
Cho Ba(OH)2 dư:
\(HCO3^-+OH^-\rightarrow CO3^{2-}+H2O\)
0,3____________________0,3
⇒m kết tuả= mBaCO3= 0, 3.197=59,1 g
VCO2 = 0,1.22,4= 2,24 l

Dung dịch thu được có pH = 2 nên H+ dư.
[ H+ ](dư) = 0,01 M ⇒ nH+ (dư) = 0,01(0,1+0,001V) (mol)
Ta có: \(\Sigma n_{OH^-}=2n_{Ba\left(OH\right)_2}+n_{NaOH}=2.0,1.0,1+0,1.0,1=0,03\left(mol\right)\)
\(\Sigma n_{H^+}=2n_{H_2SO_4}+n_{HCl}=2.0,001V.0,0375+0,001V.0,0125=8,75.10^{-5}V\left(mol\right)\)
PT ion: \(OH^-+H^+\rightarrow H_2O\)
______0,03 → 0,03 _________ (mol)
\(\Rightarrow\Sigma n_{H^+}=n_{H^+\left(pư\right)}+n_{H^+\left(dư\right)}\)
\(\Leftrightarrow8,75.10^{-5}V=0,03+0,01\left(0,1+0,001V\right)\)
\(\Rightarrow V=400\left(ml\right)\)
Bạn tham khảo nhé!

Áp dụng ĐLBT điện tích
0,07 - 2x - 0,1 = 0 =>x=0,015 mol
y + 2z =0,02
trộn X với Y có H+ >< OH- Ba2+ >< SO42-
dd có pH=2 => dd có mt axit => H+ dư OH- hết => \(\left[H^+\right]\)=0,01 => nH+=0,005
H+ + OH- ------> H2O
bđ y 0,1
pư 0,1 <- 0,1
spư y-0,1
=> y - 0,1 = 0,005 => y = 0,105 mol =.> z =
có sai đề k bạn