Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

ta có :
nBr2=\(\dfrac{16}{160}=0,1mol\)
C2H4+Br2->C2H4Br2
0,1------0,1
=>VC2H4=0,1.22,4=2,24l
=>VCH4=3,36l->n CH4=0,15 mol
->%VC2H4=\(\dfrac{2,24}{5,6}.100\)=40%
=>%VCH4=60%
c)
CH4+2O2-to>CO2+2H2O
0,15---------------0,15
C2H4+3O2--to>2CO2+2H2O
0,1--------------------0,2
=>m CaCO3=0,35.100=35g

a)
\(n_{Br_2}=\dfrac{8}{160}=0,05\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
0,05<-0,05
=> \(n_{CH_4}=\dfrac{3,36}{22,4}-0,05=0,1\left(mol\right)\)
\(\%m_{CH_4}=\dfrac{0,1.16}{0,1.16+0,05.28}.100\%=53,33\%\)
\(\%m_{C_2H_4}=\dfrac{0,05.28}{0,1.16+0,05.28}.100\%=46,67\%\)
b)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,1-->0,2
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,05--->0,15
=> \(V_{O_2}=\left(0,2+0,15\right).22,4=7,84\left(l\right)\)

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
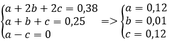
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

a) \(n_{Br_2\left(p\text{ư}\right)}=\dfrac{6,4}{160}=0,04\left(mol\right);n_{hh}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,04<--0,04
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,04}{0,6}.100\%=6,67\%\\\%V_{CH_4}=100\%-6,67\%=93,33\%\end{matrix}\right.\)
b) \(n_{CH_4}=0,6-0,04=0,56\left(mol\right)\)
PTHH: \(CH_4+2O_2\xrightarrow[]{t^o}CO_2+2H_2O\)
0,56----------->0,56
\(C_2H_4+3O_2\xrightarrow[]{t^o}2CO_2+2H_2O\)
0,04----------->0,08
\(\Rightarrow V_{CO_2}=\left(0,08+0,56\right).22,4=14,336\left(l\right)\)

- Phần 1 tác dụng với Br2: nBr2 = 16:160 = 0,1 mol
C2H2 + 2Br2 → C2H2Br4
0,05 ← 0,1 (mol)
- Đặt số mol khí mỗi phần như sau:
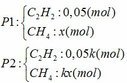
+ Số mol hỗn hợp khí X là: nX = 11,2:22,4 = 0,5 mol
Ta có: n khí P1 + n khí P2 = nX => 0,05 + x + 0,05k + kx = 0,5 <=> (x + 0,05)k = 0,45 - x
=> 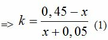
+ Đốt cháy phần 2:
C2H2 + 2,5O2 → t ∘ 2CO2 + H2O
0,05k → 0,1k→ 0,05k (mol)
CH4 + 2O2 → t ∘ CO2 + 2H2O
kx → kx → 2kx (mol)
Sản phẩm cháy gồm
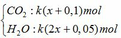
dẫn qua dung dịch Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
k(x+0,1) → k(x+0,1) (mol)
Khối lượng dung dịch giảm: m dd giảm = mBaCO3 – mCO2 – mH2O
=> 197k(x+0,1) – 44k(x+0,1) – 18k(2x+0,05) = 69,525
=> 153k(x+0,1) – 18k(2x+0,05) = 69,525
=> k(117x+14,4) = 69,525
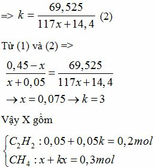
CaC2 + 2H2O → Ca(OH)2 + C2H2
0,2 ← 0,2 (mol)
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
0,1 ← 0,1 (mol)
Giá trị của m là: m = mCaC2 + mAl4C3 = 0,2.64 + 0,1.144 = 27,2 gam
Phần trăm thể tích các khí trong X là:

tác dụng với AgNO3 trong NH3 dư:
C2H2 + 2AgNO3 + 2NH3 → Ag2C2↓ + 2NH4NO3
0,15 → 0,15 (mol)
Khối lượng kết tủa thu được là: mAg2C2 = 0,15.240 = 36 gam

a)
C2H4 + Br2 --> C2H4Br2
C2H2 + 2Br2 --> C2H2Br4
b)
Gọi \(\left\{{}\begin{matrix}n_{C_2H_4}=a\left(mol\right)\\n_{C_2H_2}=b\left(mol\right)\end{matrix}\right.\) => \(a+b=\dfrac{13,44}{22,4}=0,6\) (1)
PTHH: C2H4 + Br2 --> C2H4Br2
a--->a
C2H2 + 2Br2 --> C2H2Br4
b--->2b
=> \(a+2b=0,8.1=0,8\) (2)
(1)(2) => a = 0,4 (mol); b = 0,2 (mol)
PTHH: C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,4--->1,2
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
0,2---->0,5
=> \(V_{O_2}=\left(1,2+0,5\right).22,4=38,08\left(l\right)\)
=> Vkk = 38,08 : 20% = 190,4 (l)

Thể tích khí đã tác dụng với dung dịch brom là : 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là :
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C 2 H 4
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH 4
% V C 2 H 4 = 4,48/6,72 x 100% = 66,67%; V CH 4 = 33,33%
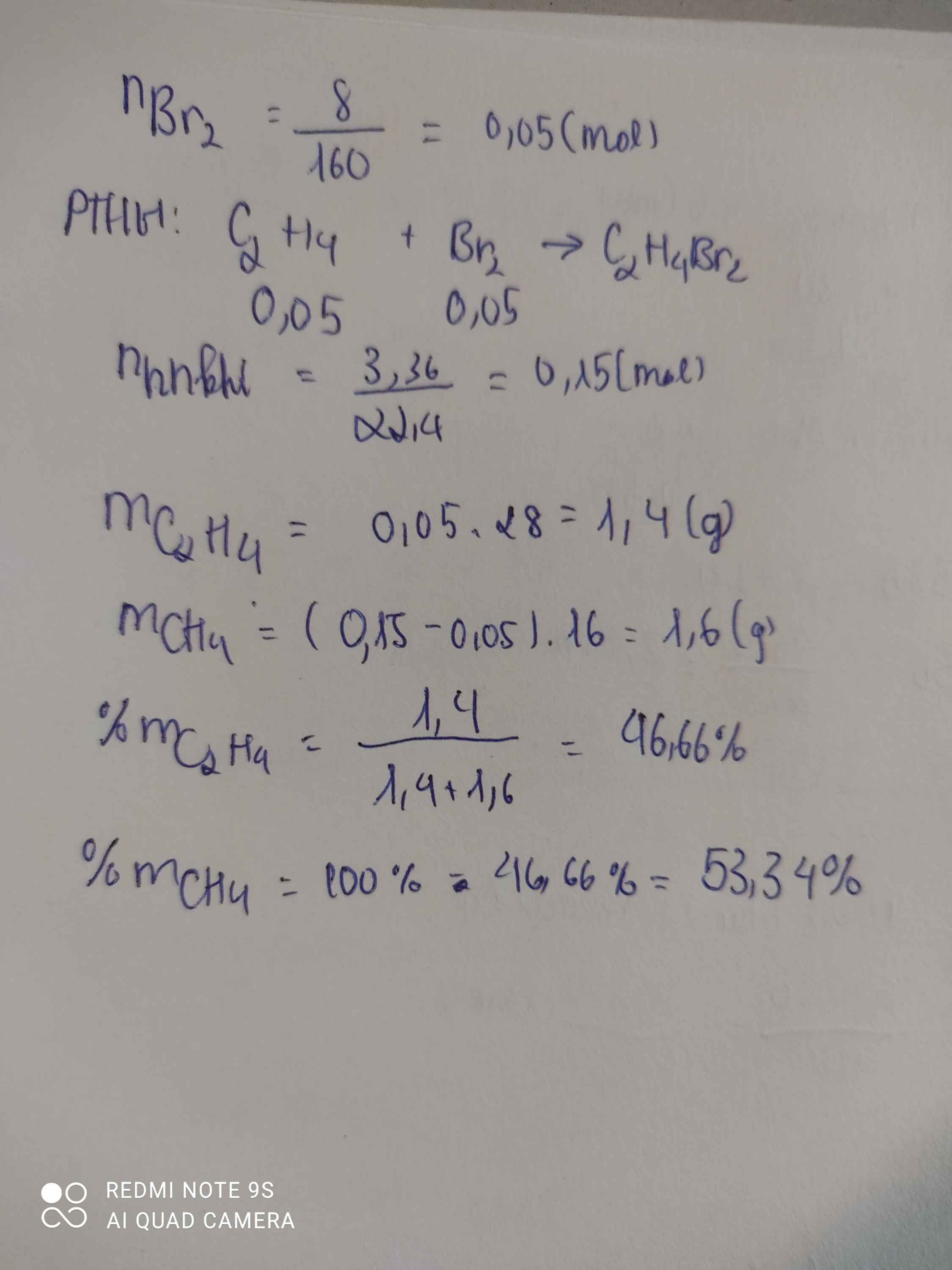
\(n_{Br_2}=\dfrac{8}{160}=0,05mol\)
\(n_{hh}=\dfrac{5,6}{22,4}=0,25mol\)
\(C_2H_4+Br_2\rightarrow C_2H_2Br_4\)
0,05 0,05 ( mol )
\(\%V_{C_2H_4}=\dfrac{0,05}{0,25}.100=20\%\)
\(\%V_{CH_4}=100\%-20\%=80\%\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,2 0,4 ( mol )
\(C_2H_4+5O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
0,05 0,25 ( mol )
\(V_{kk}=V_{O_2}.5=\left(0,4+0,25\right).22,4.5=14,56.5=72,8l\)