Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a.PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(b.n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=\dfrac{m}{M}=\dfrac{3,65}{\left(1+35,5\right)}=0,1\left(mol\right)\)
Tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{2}\Rightarrow Zn\) dư và dư \(m_{Zn}=n.M=0,2.65=13\left(g\right)\)
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
1 2 1 1
0,05 0,1 0,05 0,05
\(m_{ZnCl_2}=n.M=0,05.\left(65+35,5.2\right)=6,8\left(g\right)\\ m_{H_2}=n.M=0,05.2=0,1\left(g\right).\)
a)\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
b)\(n_{Zn}=\dfrac{13}{65}=0,2\left(m\right)\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(m\right)\)
\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
ta có tỉ lệ:\(\dfrac{0,2}{1}>\dfrac{0,1}{2}=>Zn\) dư
\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
tỉ lệ :1 2 1 2
số mol :0,05 0,1 0,05 0,05
\(m_{ZnCl_2}=0,05.136=6,8\left(g\right)\)
\(m_{H_2}=0,05.2=0,1\left(g\right)\)

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol)\\ a,PTHH:Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\)
\(b,\) Đặt \(n_{Fe}=x(mol);n_{Al}=y(mol)\)
\(\Rightarrow 56x+27y=8,3(1)\)
Theo PTHH: \(x+1,5y=0,25(2)\)
\((1)(2)\Rightarrow x=y=0,1(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,1.56}{8,3}.100\%=67,47\%\\ \%_{Al}=100\%-67,47\%=32,53\%\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\
n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\
pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(LTL:\dfrac{0,2}{1}< \dfrac{0,25}{1}\)
=> H2SO4 dư
\(n_{H_2}=n_{H_2SO_4\left(p\text{ư}\right)}=n_{Fe}=0,2\left(mol\right)\\
V_{H_2}=0,2.22,4=4,48l\\
m_{H_2SO_4\left(d\right)}=\left(0,25-0,2\right).98=4,9g\)

a)
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
b)
$n_{Fe_2O_3} = 0,15(mol) ; n_{H_2SO_4} = 0,3(mol)$
Ta thấy:
$n_{Fe_2O_3} : 1 > n_{H_2SO_4} : 3$ nên $Fe_2O_3$ dư
$n_{Fe_2O_3\ pư} = 0,1(mol)$
$\Rightarrow m_{Fe_2O_3\ dư} = 24 - 0,1.160 = 8(gam)$

ta có nhôm (Al) tác dụng với axit sunfuric (H2SO4) thu được khi hidro( h2) và hợp chất nhôm sunfat Al2(SO4)3 nên có phương trình hóa học: Al + H2SO4 -> H2 + Al2(SO4)3
theo định luật bảo tồn khối lượng ta có :
m Al + m H2SO4 = m H2+ m Al2(SO4)3
Câu cuối tính m mình chưa biết tính cái chi nên không tính được.
chúc bạn học tốt nhé

\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH :
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Trc p/u : 0,4 0,5
p/u: 0,25 0,5 0,25 0,25
sau p/u : 0,15 0 0,25 0,25
b, ----> sau p/ư ; Zn dư
\(m_{Zndư}=0,15.65=9,75\left(g\right)\)
PTHH :
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Từ PTHH ta có , 1 mol Al sẽ cho ra 1,5 mol H2
1 mol Fe sẽ cho ra 1 mol H2
Mà Al lại có Khối lượng mol nhỏ hơn Fe
Vậy , nếu cho cùng 1 khối lượng 2 kim loại trên thì Al sẽ cho ra nhiều H2 hơn
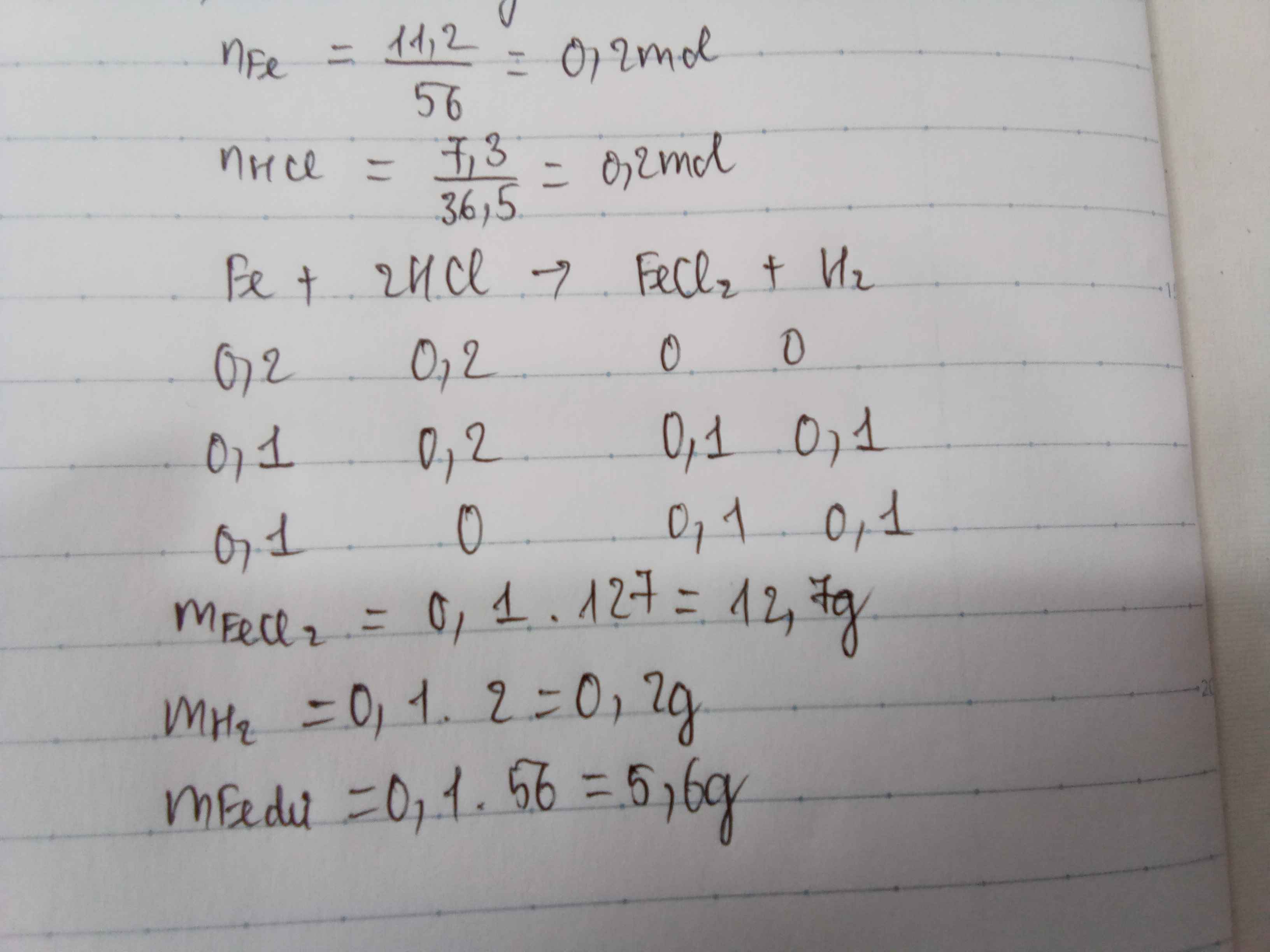
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{0,2}{2}\) > \(\dfrac{0,2}{6}\) ( mol )
1/15 0,2 1/15 0,1 ( mol )
\(m_{AlCl_3}=\dfrac{1}{15}.13,5=8,9g\)
\(m_{H_2}=0,1.2=0,2g\)
\(m_{Al\left(dư\right)}=\left(0,2-\dfrac{1}{15}\right).27=3,6g\)