Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 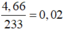 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.

Câu 1:
\(\left\{{}\begin{matrix}n_{Cu}=0,06\left(mol\right)\\n_{HNO3}=0,08\left(mol\right)\\n_{HCl}=0,08\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H^+}=n_{HNO3}+n_{HCl}=0,16\left(mol\right)\)
\(n_{NO3^-}=n_{HNO3}=0,08\left(mol\right)\)
PTHH :
\(3Cu+8H^++2NO^-_3\rightarrow3Cu^{2+}+2NO+4H_2O\)
Theo PT , đề bài ta thấy Cu và H+ hết NO3− dư
\(\Rightarrow n_{NO}=\frac{2}{3}n_{Cu}=0,06.\frac{2}{3}=0,04\left(mol\right)\)
\(\Rightarrow V_{NO}=0,04.22,4=0,896\left(l\right)\)

\(n_{H^+} = n_{HCl} + n_{HNO_3} = 0,4 + 0,4.1,2 = 0,88\)
\(Gọi\ n_{Fe} = a ;n_O = b ; n_{NO} = c\)
Suy ra :
56a + 16b = 12,48(1)
Bảo toàn electron : 3a = 2b + 3c(2)
\(n_{H^+\ pư} = 2n_O + 4n_{NO} = 2b + 4c(mol)\\ n_{H^+\ dư} = 0,88 - 2b - 4c\)
\(2Fe^{3+} + Cu \to Cu^{2+} + 2Fe^{2+}\\ 3Cu + 8H^+ + 2NO_3^- \to 3Cu^{2+} + 2NO + 4H_2O\)
\(n_{Cu} = 0,12(mol)\)
Theo PTHH :
0,5a + \(\dfrac{3}{8}\)(0,88 - 2b -4c) = 0,12(3)
(1)(2)(3) suy ra a = 0,216 ; b = 0,024 ; c = 0,2
Suy ra V = 0,2.22,4 = 4,48(lít).Đáp án B

\(n_{Cu} = 0,1\ mol\\ n_{HNO_3} = 0,6\ mol\)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
0,1........\(\dfrac{4}{15}\)..........................................................(mol)
\(n_{H^+\ dư} = 0,6 - \dfrac{4}{15} = \dfrac{1}{3}(mol)\)
Khi thêm HCl,\(n_{H^+} = \dfrac{1}{3} + 0,2.2 = \dfrac{11}{15}\)
\(3Cu + 8H^+ + 2NO_3^- \to 3Cu^{2+} + 2NO + 4H_2O\)
\(n_{H^+} < 4n_{NO_3^-} = 0,6.4\) nên NO3- dư.
Theo PTHH :
\(n_{Cu} = \dfrac{3}{8}n_{H^+} = \dfrac{3}{8}.\dfrac{11}{15} = 0,275(mol)\\ \Rightarrow m_{Cu} = 0,275.64 = 17,6(gam)\)

1/ Gọi x, y lần lượt là số mol của Na2CO3 và KHCO3.
Khi cho từ từ HCl vào dung dịch A thì các phản ứng xảy ra lần lượt là :
CO3^2- + H^+ => HCO3-
x ---------> x ----------> x
HCO3^- + H+ => H2O + CO2.
0,045 <--- 0,045 <-------- 0,045
.........HCO3^- + OH- => CO3^2- + H2O.
x+y - 0,045 -------------> x+y-0,045.
Giải hệ: x+y-0,045 = 29,55/197; n HCl = x+ 0,045 = 0,15.
=> x = 0,105 ; y = 0,09.
2/ Nồng độ của HCO3- , CO3^2- lần lượt là 0,225 M; 0,2625 M.
3/ Cho từ từ dung dịch A vào bình đựng 100 ml dung dịch HCl 1,5 M => Các phản ứng xảy ra đồng thời:
CO3^2- + 2 H^+ => H2O + CO2.
HCO3- + H+ => H2O + CO2.
Do tỉ lệ trong hỗn hợp : n CO3^2-/ n HCO3- = 7/6 => 7x*2+6x = 0,15 => x=0,0075.
=> V = 2,184 lít.

Chất rắn không tan là Cu chưa pư.
⇒ mCu (dư) = 6 (g)
Ta có: 56nFe + 64nCu (pư) = 30 - 6 (1)
\(n_{HNO_3}=0,52.2=1,04\left(g\right)\Rightarrow n_{NO}=\dfrac{1,04}{4}=0,26\left(mol\right)\)
BT e, có: 2nFe + 2nCu (pư) = 3nNO = 0,78(2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,12\left(mol\right)\\n_{Cu\left(pư\right)}=0,27\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,27.64+6}{30}.100\%=77,6\%\)

\(\left\{{}\begin{matrix}m_{Fe}=0,4m\left(g\right)\\m_{Cu}=0,6m\left(g\right)\end{matrix}\right.\)
Do sau phản ứng, KL dư => HNO3 thiếu
\(m_{KL}\) sau pư = 0,7m \(m_{Cu\left(bđ\right)}=0,6m\) => Fe dư
=> Sau pư có \(Fe^{+2}\), Fe dư và Cu k pư
Gọi số mol Fe phản ứng là a (mol)
\(n_{HNO_3}=0,2.2=0,4\left(mol\right)\)
Có: \(Fe^0-2e\rightarrow Fe^{+2}\)
____a----->2a----->a____(mol)
\(NO_3^-+4H^++3e\rightarrow NO+2H_2O\)
_______0,4 ----->0,3______________(mol)
Áp dụng ĐLBT e => 2a = 0,3
=> a = 0,15 (mol)
\(n_{Fe\left(NO_3\right)_2}=0,15\left(mol\right)\)
=> \(m_{Fe\left(NO_3\right)_2}=0,15.180=27\left(g\right)\)
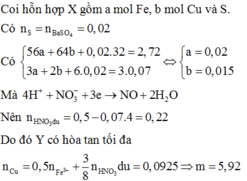
Chọn D
nHNO3 = 0,1 mol; nHCl = 0,5 mol
3Cu + 2HNO3 +6HCl → 3CuCl2 + 2NO +4H2O
→ HNO3 hết; nCu = 1,5. nHNO3 = 0,15 mol → mCu = 9,6g.