Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có số mol brom chỉ giảm đi một nửa chứng tỏ hidrocacbon đã phản ứng hết và brom dư.
Dễ tính được ![]()
![]()
Số liên kết ![]() trung bình của hỗn hợp:
trung bình của hỗn hợp: ![]()
Ta xét 2 trường hợp
TH1: Có một chất là ankan.
Thì chất không no còn lại sẽ có m = 6,7 (gam) và có số mol ![]() ( trong đó k là độ bất bão hòa của hidrocacbon chưa no đó)
( trong đó k là độ bất bão hòa của hidrocacbon chưa no đó)
Khối lượng mol phân tử của hợp chất này bằng
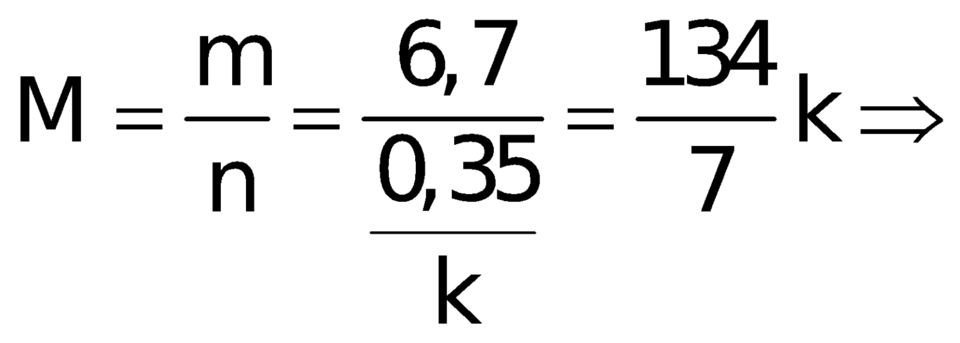 không có chất nào thỏa mãn
không có chất nào thỏa mãn
TH2: Một chất là anken, một chất còn lại là hidrocacbon chưa no có ![]()
Mặt khác ta có ![]() có một chất có M < 33,5
có một chất có M < 33,5
Tới đây ta xét tiếp 2 trường hợp nhỏ:
+) Chất có M < 33,5 là anken ![]() chỉ có thể là C2H4
chỉ có thể là C2H4 ![]() không có đáp án thỏa mãn
không có đáp án thỏa mãn
+) Chất có M < 33,5 là hidrocacbon chưa no có ![]() chất đó là axetilen, chất còn lại phải là anken
chất đó là axetilen, chất còn lại phải là anken
Đáp án B

Đáp án B
Giả sử chỉ có 1 hidrocacbon tham gia phản ứng với Br2
Ta có
Mhidrocacbon = 6,7x : 0,35 = 19,14x ( x là số liên kết pi trong hiđrocacbon đó )
→ Loại đáp án D.
Vậy là cả 2 hidrocacbon đều tham gia phản ứng với Br2
Dựa vào các đáp án A B C đều gồm 1 anken và 1 ankin Do đó
Gọi số mol anken A CnH2n là x ; Số mol ạnkin B CmH2m-2 là y
Giải ra được x = 0,05 ; y = 0,15
Khối lượng của hỗn hợp X : 0,05 × 14n + 0,15 × ( 14m - 2 ) = 6.7
→ n + 3m = 10;
→ n = 4 ; m = 2
→ C4H8 và C2H2

Đáp án C
Định hướng tư duy giải
Ta có:
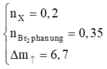
Bài toán này tốt nhất chúng ta kết hợp suy luận từ đáp án.
+ Từ số mol X và mol Br2 → X không phải 2 ankin → loại D.
+ Nếu X là ankin và ankan thì số mol C2H2 là 0,1 → Loại B.
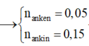
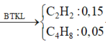
![]()

Theo gt ta có: $n_{X}=0,2(mol);n_{Br_2}=0,7(mol)$
Suy ra $M_{tb}=33,5$. Do đó 1 chất là $C_2H_4$ hoặc $C_2H_2$
+, 1 chất là $C_2H_4$
Gọi số mol 2 chất lần lượt là a;b(mol)
Ta có: $a+2b=0,35;a+b=0,2\Rightarrow a=0,05;b=0,15$
Suy ra chất còn lại có M bằng 35,3 (Loại)
+, 1 chất là $C_2H_4$
Suy ra $n_{C_2H_2}=0,15(mol);n_{M}=0,05(mol)$
Suy ra chất M có M bằng $C_4H_8$
Cái đoạn " Suy ra chất còn lại có M=35,3 là sao vậy ạ??"

Đáp án B
nhỗn hợp X = 0,2 mol,
![]()
Gọi công thức chung của các chất trong hỗn hợp X là ![]()
Ta có:
![]()
![]() loại đáp án A và D.
loại đáp án A và D.
Măt khác
![]()
Do đó loại đáp án C.

Đáp án C
nCO2 = 0,36 mol. Bảo toàn nguyên tố Oxi: nH2O = 0,33 mol.
Do nZ = 0,04 mol = nH2 ban đầu ⇒ Z là ankan, H2 hết.
● Đối với HCHC chứa C, H và O (nếu có) thì: nCO2 – nH2O = (k – 1).nHCHC
nCO2 – nH2O = k.nHCHC – nHCHC = nπ – nHCHC.
Công thức trên vẫn đúng với hỗn hợp HCHC chứa C, H và có thể có O.
► Áp dụng: nπ = nH2 + nBr2 = 0,15 mol ⇒ nX = 0,12 mol.
Do cuối cùng chỉ chứa 1 ankan ⇒ X gồm các hidrocacbon có cùng số C.
số C/Z = 0,36 ÷ 0,12 = 3 ⇒ Z là C3H8 || mX = 0,36 × 12 + 0,33 × 2 = 4,98(g).
||⇒ bảo toàn khối lượng: a = 4,98 + 0,04 × 2 – 0,04 × 44 = 3,3(g)

Đáp án C
Khí thoát ra khỏi bình là Y ; nCO2 = 0,03 ; nH2O= 0,04
→ Y là ankan → nY = 0,04 - 0,03 = 0,01 → Y là C3H8
Đốt cháy X thu được nCO2 = nH2O
→ nC2H2= nC3H8 = 0,01 mol
→ nC2H4 = ( 0,82 - 0,01 × 26 ) : 28 = 0,02 mol
→ nX = 0,01 + 0,02 + 0,01 = 0,04 → VX = 0,896 (l)
ta gọi chung là 14X = 6,7/0,2 X = 2 ta có ankin là c2h2
ta có hpt
mol anken + mol ankin = 0,2
mol anken + 2 mol ankin = 0,35
=> mol anken = 0,05 mol ankin là 0,15
thay vào ta có 26*0,15 +14 n *0,05=6,7
=> n = 4 anken là c4h8